微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C、D、E为前四周期中原子序数依次增大的元素,相关的信息如下:
元素
| 相关信息
|
A
| A元素原子核外只有三个能级,且每个能级上含有相等的电子数
|
B
| 是空气中含量最丰富的元素
|
C
| 短周期中,单质C的金属性最强
|
D
| 基态原子第三能层上有7种运动状态不同的电子
|
E
| 一种核素的质量数为63,中子数为34
|
?
请用对应的元素符号回答下列问题:
(1)A与氢可形成一种的分子式为A2H4化合物,该分子中存在σ键与π键数目比为?。
(2)H—A、H—B两种共价键中,键能较大的是?;H—A、H—D两种共价键中,键的极性较强的是?
(3)E位于周期表中的位置是??,单质E与B的最高价氧化物的水化物的稀溶液反应的离子方程式为?。
(4)根据下列能量变化示意图,请写出BO和AO2反应的热化学方程式?。
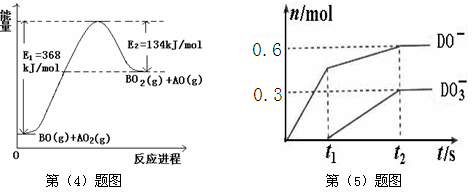 ?
?
(5)C的最高价氧化物对应的水化物为M,M中含有的化学键类型为?。将一定量的D2通入一定浓度M的水溶液中,两者恰好完全反应时,生成物中有三种含D元素的离子,其中两种离子的物质的量(n)与反应时间(t)的变化示意图如上图所示。请写出t2时刻总反应方程式
参考答案:
25⑴5:1(2分)
⑵H-C (2分)? H-Cl(2分)?第一空填H-C、H-N均可,
⑶第四周期第IB 族 (2分)
3Cu + 8H+ + 2NO3- = 3Cu2++2NO↑ + 4H2O(2分)?写成普通化学方程式,不得分;离子符号或化学式错,不得分;配平错,扣1分。
⑷NO(g)+ CO2(g)=NO2(g)+CO(g)
△H ="+234" kJ/mol(2分)?须正确标明物质状态、△H的数值、“+”号及单位,有一处错误即不得分。
⑸离子键、极性键?(2分)?各1分,“极性键”写成“共价键”或“极性共价键”也可。多填其它类型,每多填一个扣1分。
5Cl2+10NaOH = 7NaCl+2NaClO+NaClO3+5H2O(2分)?写离子方程式也可。化学式(或离子符号)错,不得分;配平错,扣1分。
本题解析:
根据信息可以推知A、B、C、D、E分别为C、N、Na、Cl、Cu元素。
(1)A2H4为乙烯,其结构简式为CH2=CH2,其σ键与π键数分别为5、1,故之比为5:1;
(2)键能跟键长有关系,键越断,键能越高,故有H—C<H—N;极性跟电负性有关,电负性越大,吸引力越大,极性越强,故H—C<H—Cl;
(3)为Cu与稀硝酸的反应
(4)从图中可以看出,生成物的总能量大于反应物总能力,故该反应为吸热反应,故有△H ="+234" kJ/mol;
(5)NaOH与氯气反应可能生成Cl-和ClO-或Cl-和ClO3-;从图中看出n(ClO-):n(ClO3-)=2:1,从而写出反应方程式。
本题难度:一般
2、填空题 (8分)根据下列五种元素的第一至第四电离能数据(单位:kJ/mol),回答下面各题:

(1)在周期表中,最可能处于同一族的是___________
A.Q和R? B.E和T? C.T和U? D.R和T? E.R和U
(2)下列离子的氧化性最弱的是____________
A.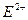 ? B.R+? C.T3+?D.
? B.R+? C.T3+?D.
(3)下列元素中,化学性质和物理性质最像Q元素的是____________
A.硼? B.铍? C.氦? D.氢?
(4)T元素最可能是_______区元素,其氯化物的化学式为___________________
(5)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明了原子核外________________________________________________。
(6)如果R、E、T是同周期的三种主族元素,其中元素_______的第一电离能反常高的原因是____?_________。
参考答案:共8分,每空1分)
(1)E?
(2)D?
(3)C?
(4)p,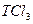 ?
?
(5)电子分层排布,各能层能量不同
(6)E,E元素的最外层电子处于s能级全充满,能量较低,比较稳定,失去一个电子吸收的能量较多
本题解析:略
本题难度:一般
3、选择题 主族元素R的最高正化合价为+2,R元素位于周期表的
A.ⅠA族
B.ⅡA族
C.ⅢA族
D.ⅤA族
参考答案:B
本题解析:
正确答案:B
主族元素的族序数=最高正价。
本题难度:一般
4、填空题 (7分)有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)A是________,B是________,E是_________。
(2)写出C元素基态原子的电子排布式_________________________。
(3)用轨道表示式表示D元素原子的价电子构型____________________。
(4)元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是___________。(填“>”、“<”或“=”)
参考答案:(1)H、O、K?(2)[Ne]3S23P1(3)略(4)O>S,Al>K
本题解析:略
本题难度:简单
5、实验题 (13分)下表是周期表中的一部分,根据A—K在周期表中的位置,按要求回答下列问题:

| ?
ⅠA
| ?
ⅡA
| ?
ⅢA
| ?
ⅣA
| ?
ⅤA
| ?
ⅥA
| ?
ⅦA
| ?
0
|
1
| A
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
2
| ?
| ?
| ?
| B
| C
| ?
| D
| ?
|
3
| E
| F
| G
| H
| I
| J
| K
| ?
|
(1)上表A—K元素中,只有负价而无正价的元素是(写出元素名称,下同)?,金属性最强的元素是?,原子半径最小的元素是?
(2)比较D-、E+及K-的离子半径,由大到小的顺序为:?
(3) 气态氢化物最稳定的是(填物质的化学式)? ?。写出元素 C、K的气态氢化物相互反应的现象?,反应化学方程式为:??。
?。写出元素 C、K的气态氢化物相互反应的现象?,反应化学方程式为:??。
(4) (本小题均填物质的化学式)在最高价氧化物的水化物中,碱性最强的是(填物质的化学式,下同)?,酸性最强的是?,呈两性的是?,写出元素E、K的最高价氧化物对应水化物相互反应的离子方程式为?
参考答案:(共13分) (1)氟,钠,氢(各1分) (2) Cl->F->Na+ (1分) (3) NaOH, HClO4, Al(OH)3 , (各1分) OH-+H+=H2O ?(2分) ?(4) HF?(1分) ?产生白烟(1分),NH3+HCl=NH4Cl?(2分) (共13分) (1)氟,钠,氢(各1分) (2) Cl->F->Na+ (1分) (3) NaOH, HClO4, Al(OH)3 , (各1分) OH-+H+=H2O
?(2分) ?(4) HF?(1分) ?产生白烟(1分),NH3+HCl=NH4Cl?(2分) (共13分) (1)氟,钠,氢(各1分) (2) Cl->F->Na+ (1分) (3) NaOH, HClO4, Al(OH)3 , (各1分) OH-+H+=H2O ?(2分) ?(4) HF?(1分) ?产生白烟(1分),NH3+HCl=NH4Cl?(2分)
?(2分) ?(4) HF?(1分) ?产生白烟(1分),NH3+HCl=NH4Cl?(2分)
本题解析:略
本题难度:一般