微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
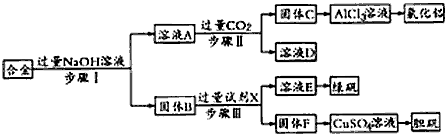
1、实验题 为探索工业废料的再利用,某化学兴趣小组设计了如图实验方案,用含有铝、铁和铜的合金制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
请回答:
(1)步骤I、Ⅱ、Ⅲ中均需进行的实验操作是________________。
(2)溶液A中的离子主要有____________;试剂X是_______。
(3)进行步骤Ⅱ时,该小组用如图所示装置及试剂将制得的CO2气体通入溶液A中。一段时间后,观察到烧杯中产生的白色沉淀逐渐减少,其原因是____________________ (用离子方程式表示);为了避免固体C减少,根据下图所示,改进的措施是___________________。

(4)从环境保护角度考虑,用固体F制备CuSO4溶液的化学方程式是____________________。
参考答案:(1)过滤
(2)Na+、AlO2-、OH-;稀硫酸
(3)Al(OH)3 +3H+ = Al3+ +3H2O;在装置I、Ⅱ之间增加一个盛有饱和NaHCO3溶液的洗气瓶(合理答案即给分)
(4) 2Cu+ O2+ 2H2SO4 = 2CuSO4+2H2O
本题解析:
本题难度:一般
2、选择题 用含少量铁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是
[? ]
①加盐酸溶解; ②加烧碱溶液溶解;?③过滤;?④通入过量CO2生成Al(OH)3沉淀; ⑤加入盐酸生成Al(OH)3沉淀; ⑥加入过量烧碱溶液。
A.①⑥⑤③
B.②③⑤③
C.②③④③
D.①③⑤③
参考答案:C
本题解析:
本题难度:一般
3、实验题 晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅
②粗硅与干燥HCl气体反应制得SiCl3:Si+3HCl SiCl3+H2
SiCl3+H2
③SiCl3与过量H2在1000~1100℃反应制得纯硅已知SiCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为__________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiCl3(沸点33.0℃)中含有少量SiCl4(沸点57.6℃)和HCl(沸点-84.7℃),提纯SiCl3采用的方法为:___________________。
(3)用SiCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去)
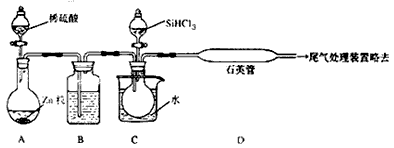
①装置B中的试剂是___________,装置C中的烧瓶需要加热,其目的是___________。
②反应一段时间后,装置D中观察到的现象是___________,装置D不能采用普通玻璃管的原因是______________________,装置D中发生反应的化学方程式为___________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及______________________。
④为鉴定产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是___________。
a.碘水 b.氯水 c.NaOH溶液 D.KSCN溶液 E.Na2SO3溶液
参考答案:(1)SiO2+2C Si+2CO↑
Si+2CO↑
(2)分馏(或蒸馏)
(3)①浓硫酸;使滴入烧瓶中的SiHCl3气化;②有固体物质生成;在反应温度下,普通玻璃会软化;
SiHCl3+H2 Si+3HCl;③排尽装置中的空气;④bd
Si+3HCl;③排尽装置中的空气;④bd
本题解析:
本题难度:一般
4、填空题 复印机使用的墨粉主要成分是Fe3O4,下图是氧化沉淀法生产Fe3O4的工艺:
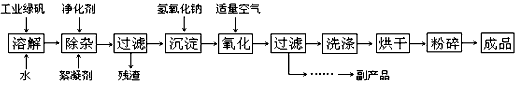
已知:① 工业绿矾中FeSO4的含量为52.5%,其中的杂质不参与反应;
② Fe(OH)2+2Fe(OH)3=Fe3O4·4H2O
请回答下列问题:
(1)铁的常见氧化物有_________________ ;
(2)Fe3O4与稀硝酸反应的离子方程式是___________ ,检验反应后的溶液中含Fe3+的方法_______ ;
(3)在工艺流程中,通入适量空气“氧化”时的化学方程式是:____________________ ;
(4)生产中可获得的副产品是__________,提取该副产品的操作顺序是_________ (填写序号)
a.过滤 b.加热浓缩 c.冷却 d.结晶 e.洗涤
(5)在生产过程中,若工业绿矾的投料速率是12.16 kg/h,为使产品较纯,鼓入空气的速率应为_______________ m3/h(假设反应在标准状态下进行,空气中O2占20%)。
参考答案:(1)FeO、Fe2O3、Fe3O4
(2)3Fe3O4 + 28H++NO3-=9Fe3++NO↑+14H2O;取待测液少许于试管中,加入适量的KSCN溶液,若溶液显血红色,则证明含Fe3+
(3)4Fe(OH)2+2H2O+O2=4Fe(OH)3
(4)Na2SO4·10H2O(或芒硝,写Na2SO4也可); bcdae
(5)0.784
本题解析:
本题难度:一般
5、实验题 硫酸亚铁容易被氧化,而硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O]较稳定,常用于代替硫酸亚铁作还原剂。现以铁屑为主要原料制备硫酸亚铁铵晶体的反应如下:Fe +H2SO4(稀)=FeSO4+H2↑、FeSO4+(NH4)2SO4+6H2O=(NH4)2SO4·FeSO4·6H2O。
步骤1:在盛有适量铁屑的锥形瓶中加入某种试剂除去油污,加热,充分反应后过滤、洗涤、干燥、称量,铁屑质量为m1;
步骤2:将处理过的铁屑加入到一定量的稀硫酸中,加热至50~80℃充分反应,趁热过滤并用少量热水洗涤,滤液及洗涤液都转移至蒸发皿中。滤渣干燥后称重,剩余铁屑质量为m2;
步骤3:准确称取所需质量的硫酸铵晶体加入“步骤2”的蒸发皿中,搅拌使之溶解,缓缓加热一段时间,将其冷却、结晶、过滤。用无水乙醇洗涤晶体并自然干燥,称量所得晶体质量为m3。
回答下列问题:
(1)能够用于除去铁屑表面油污的试剂是_________(填字母)。
A.纯碱溶液 B.烧碱溶液 C.明矾溶液 D.稀硫酸
(2)实验中三次用到过滤操作,完成该操作的玻璃仪器有________________;步骤2中趁热过滤的目的是_____________________。
(3)硫酸亚铁在潮湿的空气中易被氧化生成一种物质(碱式硫酸铁),该反应的化学方程式为________________________。
(4)铁屑表面常有少量的铁锈(Fe2O3·nH2O),对FeSO4的制备_______(填“有”或“无”)影响,理由是
_________________________ (用离子方程式回答)。
(5)若忽略铁锈的影响,上述实验中硫酸亚铁铵晶体的产率为____________。
(6)请设计一个简单的实验,检验硫酸亚铁铵晶体中含有结晶水___________________________ (简述实验操作、现象和结论)。
参考答案:(1)AB
(2)玻璃棒、烧杯、漏斗;避免FeSO4因结晶而造成损失
(3)4FeSO4+O2+2H2O=4Fe(OH)SO4
(4)无;Fe2O3+6H+=2Fe3++3H2O、2Fe3++Fe=3Fe2+
(5)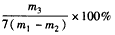
(6)取少量硫酸亚铁铵晶体于试管中,用酒精灯加热,在试管口有液体(水珠)生成,说明其中含有结晶水
本题解析:
本题难度:一般