微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (9分)用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.20mol·L -1的氢氧化钠溶液(指示剂为酚酞).滴定结果如下:
?
| NaOH起始读数
| NaOH终点读数
|
第一次
| ? 0.10mL
| ? 18.50mL
|
第二次
| ? 0.20mL
| ? 18.80mL
|
(1)根据以上数据可以计算出盐酸的物质的量浓度为?mol·L-1.
(2)达到滴定终点的标志是?
(3)以下操作造成测定结果偏高的原因可能是?。
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管
参考答案:(1)0.148或0.15mol/L ,
(2) 滴最后一滴溶液由无色变浅红色,半分钟不褪色
(3)A. ?D.E
本题解析:(1)根据表格中数据可知消耗氢氧化钠体积的平均值为18.50 mL, 0.148mol/L。
0.148mol/L。
(2)达到滴定终点的标志是滴最后一滴溶液由无色变浅红色,半分钟不褪色。
(3) 来分析结果是否变高,主要是看氢氧化钠的体积,A项混有Na2CO3杂质,消耗氢氧化钠的体积偏大,结果偏高;B项滴定终点读数时,俯视滴定管的刻度,氢氧化钠的体积偏小,结果偏低;C项无影响;D项滴定管尖嘴处悬挂一滴溶液,说明氢氧化钠的体积偏大,导致待测液浓度偏大;E项未用标准液润洗碱式滴定管,导致标准液浓度偏小,需要的体积变大,使待测液浓度变大。
来分析结果是否变高,主要是看氢氧化钠的体积,A项混有Na2CO3杂质,消耗氢氧化钠的体积偏大,结果偏高;B项滴定终点读数时,俯视滴定管的刻度,氢氧化钠的体积偏小,结果偏低;C项无影响;D项滴定管尖嘴处悬挂一滴溶液,说明氢氧化钠的体积偏大,导致待测液浓度偏大;E项未用标准液润洗碱式滴定管,导致标准液浓度偏小,需要的体积变大,使待测液浓度变大。
点评:误差分析主要考虑标准液的体积偏大、偏小等。属于较简单题。
本题难度:一般
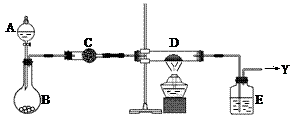
2、实验题 (16分)如右图所示,B中盛装的是一种固体物质。当A中的溶液滴入B内反应一段时间后,所得产物经装置C后可得到纯净的气体X,每个X分子中含有10个电子。D中盛装的是黑色粉末,当X气体通过D时,黑色粉末逐渐变成红色,最后从E装置中出来的气体是一种纯净的单质Y,Y在标准状况下的密度为1.25g/L。装置中A、B、C、D、E中的药品只能从下列所给试剂a~p中选择,图中某些夹持仪器未画出。
a.浓硫酸 b.浓硝酸 c.稀硝酸 d.浓盐酸 e.稀硫酸 f.浓氨水
g.铜片 h.锌片 i.碱石灰 j.硫酸铜 k.生石灰 l.硝酸铵晶体
m.固体烧碱 n.稀NaOH溶液 o.CuO p.MnO2
回答下列问题:
⑴C装置内的药品是?(用a~p中的字母表示),其作用是?。
⑵A中溶液和B中固体的所有可能的组合共有?种。
⑶纯净气体X通过D时,发生反应的化学方程式是?,反应中若转移电子的物质的量为1.2mol,则D装置中黑色固体共失重?g。
⑷E中的药品是?(用a~p中的字母表示),其作用是?。
参考答案:⑴i(或k,或m,2分);干燥氨气(2分)
⑵3(3分)
⑶2NH3+3CuO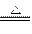 N2+3Cu+3H2O(2分);9.6(3分)
N2+3Cu+3H2O(2分);9.6(3分)
⑷a(2分);吸收水蒸汽及未反应的NH3(2分)。
本题解析:(1)由题意“单质Y在标准状况下的密度为1.25g/L”可知,M(Y)=28,单质Y为N2。又X气体通过D时,黑色粉末逐渐变成红色,且生成N2,X分子中含有10个电子,那么X为氨气。黑色粉末为CuO。(2)A中溶液和B中固体的所有可能的组合为:浓氨水与生石灰,浓氨水与固体烧碱,硝酸铵晶体与稀NaOH溶液。,共3组。(3)转移电子的物质的量为1.8mol时,参与反应的CuO的物质的量为0.9mol,CuO共失重为:0.9×16=14.4g。⑷E中的药品是用来吸收氨气和水蒸汽,要用浓硫酸。
本题难度:一般
3、选择题 实验室需用480mL 0.100 mol/L的CuSO4溶液,下列配置方法正确的是:
A.称取7.68gCuSO4固体,加入480mL水
B.称取12.0g胆矾配制成480mL溶液
C.称取8.0gCuSO4固体,加入500mL水
D.称取12.5 g胆矾配制成500mL溶液
参考答案:D
本题解析:略
本题难度:简单
4、实验题 (10 分)结合下列实验装置图回答问题:
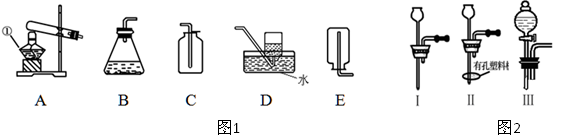
(1)某课外活动小组的同学用图1装置探究CO2的实验室制法:
①甲同学用大理石与稀盐酸反应制取CO2,应该选用的发生装置是?,收集装置是?。
②加热固体碳酸氢钠或固体碳酸氢铵都能产生CO2,其方程式分别是:
2NaHCO3 ?Na2CO3 + H2O +CO2↑
?Na2CO3 + H2O +CO2↑
NH4HCO3 ?NH3 ↑+ H2O +CO2↑
?NH3 ↑+ H2O +CO2↑
乙同学利用加热碳酸氢钠的方法制取CO2,应该选用的发生装置是?。
他不选用碳酸氢铵制取CO2的理由是?。
(2)图1中装置B虽然操作简便,但无法控制反应速率。请从图2中选取 (填序号)取代B中的单孔塞,以达到控制反应速率的目的。
参考答案:(1)①B(2分) C(2分)②A(2分)碳酸氢铵加热分解会产生CO2和NH3的混合气体,从而制得的CO2不纯。(2分)
(2)III(2分)
本题解析:(1)①大理石与盐酸反应,不需要加热,所以选择B装置。CO2能溶于水,但密度大于空气的,所以应该用向上排气法收集,答案选C。
②由于碳酸氢钠分解需要加热,且碳酸氢钠是固体,所以应该选择装置A;由于碳酸氢铵加热分解会产生CO2和NH3的混合气体,从而制得的CO2不纯,所以不选用碳酸氢铵制取CO2。
(2)要想控制反应速率,则必须选择分液漏斗,即选择装置Ⅲ。
本题难度:一般
5、实验题 甲、乙两个研究性学习小组为测定氨分子中氮、氢原子个数比,设计如下实验流程:

实验中,先用制的的氨气排尽洗气瓶前所有装置中的空气,再连接洗气瓶和气体收集装置,立即加热氧化铜。反应完毕后,黑色的氧化铜转化为红色的铜。
下图A、B、C为甲、乙两小组制取氨气时可能用到的装置,D为盛有浓硫酸的洗气瓶。

甲小组测得,反应前氧化铜的质量m1g、氧化铜反应后剩余固体的质量m2g、生成氮气在标准状况下的体积V1L。
乙小组测得,洗气前装置D的质量m3g、洗气后装置D的质量m4g、生成氨气在标准状况下的体积V2L。
请回答下列问题:
(1)写出仪器a的名称?。
(2)检查A装置气密性的操作是?。
(3)甲、乙两小组选择了不同的方法制取氨气,请将实验装置的字母编号和制备原理填写在下表的空格中。
?
| 实验装置
| 实验药品
| 制备原理
|
甲小组
| A
| 氢氧化钙、硫酸、硫酸铵
| 反应的化学方程式为? ①?。
|
乙小组
| ②
| 浓氨水、氢氧化钠
| 用化学平衡原理分析氢氧化钠的作用:? ③?。
|
(4)甲小组用所测得数据计算出氨分子中氮、氢的原子个数之比为?。
(5)乙小组用所测得数据计算出氨分子中氮、氢的原子个数比明显小于理论值,其原因是?。为此,乙小组在原有实验的基础上增加了一个装有某药品的实验仪器,重新实验。根据实验前后该药品的质量变化及生成氨气的体积,得出了合理的实验结果。该药品的名称是?。
参考答案:(1)圆底烧瓶(2分)(2)连接导管,将导管插入水中,加热试管,导管口有气泡产生,停止加热,导管内有水回流并形成一段稳定的水柱(3分)(3)①Ca(OH)2+(NH4)2SO4 CaSO4+2NH3↑+ H2O;(2分)②B(2分)氢氧化钠溶于氨水后放热,增加氢氧根浓度,使NH3+H2O
CaSO4+2NH3↑+ H2O;(2分)②B(2分)氢氧化钠溶于氨水后放热,增加氢氧根浓度,使NH3+H2O NH3·H2O
NH3·H2O NH4+ + OH-向逆反应方向移动,加快氨气逸出(2分)(4)5V1:7(m1- m2) (2分)(5)浓硫酸吸收了未参加反应的氨气,从而使计算的氢的量偏高(2分)碱石灰(氯氧化钠、氧化钙等)(2分)。
NH4+ + OH-向逆反应方向移动,加快氨气逸出(2分)(4)5V1:7(m1- m2) (2分)(5)浓硫酸吸收了未参加反应的氨气,从而使计算的氢的量偏高(2分)碱石灰(氯氧化钠、氧化钙等)(2分)。
本题解析:(1)写出仪器a是圆底烧瓶。(2)检查A装置气密性的操作是将导管接入盛水的水槽中,用水握住试管,有气泡产生,放手后能形成一段稳定的水柱,说明气密性良好。(3)①氢氧化钙和硫酸铵共热生成硫酸钙和氨气,方程式为Ca(OH)2+(NH4)2SO4 CaSO4+2NH3↑+ H2O;②乙小组用浓氨水、氢氧化钠固体制备氨气不需加热,故选用B装置。浓氨水中存在NH3+H2O
CaSO4+2NH3↑+ H2O;②乙小组用浓氨水、氢氧化钠固体制备氨气不需加热,故选用B装置。浓氨水中存在NH3+H2O NH3·H2O
NH3·H2O NH4+ + OH-,氢氧化钠固体溶于水,放出大量的热,使NH3的溶解度减小,NH3从氨水中析出,③同时氢氧化钠固体溶于水后发生电离,生成大量OH-,促使上述平衡向左移动,生成更多NH3,从而使NH3从氨水中析出。(4)甲小组2NH3+3CuO
NH4+ + OH-,氢氧化钠固体溶于水,放出大量的热,使NH3的溶解度减小,NH3从氨水中析出,③同时氢氧化钠固体溶于水后发生电离,生成大量OH-,促使上述平衡向左移动,生成更多NH3,从而使NH3从氨水中析出。(4)甲小组2NH3+3CuO 3Cu+N2+3H2O,由此可知,m1- m2为参加反应的CuO中氧的质量,物质的量为(m1- m2)/16,即NH3中H的物质的量为(m1- m2)/8。测的N2在标准状况下体积为V1L,则N原子的物质的量为V1/22.4,则氨分子中氮、氢的原子个数之比为(V1/22.4): (m1- m2)/8,化简得V1/[2.8 (m1- m2)]
3Cu+N2+3H2O,由此可知,m1- m2为参加反应的CuO中氧的质量,物质的量为(m1- m2)/16,即NH3中H的物质的量为(m1- m2)/8。测的N2在标准状况下体积为V1L,则N原子的物质的量为V1/22.4,则氨分子中氮、氢的原子个数之比为(V1/22.4): (m1- m2)/8,化简得V1/[2.8 (m1- m2)]
(5)洗气前装置D前后的质量差包含未参加反应的NH3,使得氢原子的物质的量增大,比值减小。要使没定值准确,只要找一种不吸收NH3的干燥剂即可,故可选用碱石灰。
【考点定位】本题通过NH3和氨气中N、H原子个数测定来考查化学实验基础知识,涉及到仪器的识别、气密性的检查、实验误差解释、相关计算、实验评价及设计。
本题难度:简单