微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 某温度(t ℃)时,水的离子积为KW=1.0×10-13mol2·L-2,则该温度(填“大于”、“小于”或“等于”)________25 ℃,其理由是_______________________________________。
若将此温度下pH=11的苛性钠溶液a L与pH=1的稀硫酸b L混合(设混合后溶液体积的微小变化忽略不计),试通过计算填写以下不同情况时两种溶液的体积比:
(1)若所得混合液为中性,则a∶b=________;此溶液中各种离子的浓度由大到小排列顺序是___________________________________。
(2)若所得混合液的pH=2,则a∶b=________。此溶液中各种离子的浓度由大到小排列顺序是__________________________________________。
参考答案:大于 水的电离是吸热过程,KW随温度升高而增大 (1)10∶1 c(Na+)>c(SO)>c(H+)=c(OH-)或c(Na+)=2c(SO42—)>c(H+)=c(OH-) (2)9∶2
c(H+)>c(SO42—)>c(Na+)>c(OH-)
本题解析:水的电离是吸热过程,KW随温度升高而增大,故温度高于25 ℃。
(1)稀H2SO4中,c(H+)=0.1 mol·L-1,NaOH溶液中c(OH-)=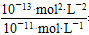 =0.01 mol·L-1
=0.01 mol·L-1
0.01 mol·L-1×a L=0.1 mol·L-1×b L
a∶b=10∶1
离子浓度关系c(Na+)>c(SO42—)>c(H+)=c(OH-)或c(Na+)=2c(SO42—)>c(H+)=c(OH-)
(2)若pH=2,则
c(H+)混=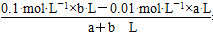 =0.01 mol·L-1
=0.01 mol·L-1
a∶b=9∶2
离子浓度关系:此时,假如原来NaOH溶液为9 L,H2SO4溶液则为2 L
n(Na+)=0.01 mol·L-1×9 L=0.09 mol
剩余n(H+)=0.01 mol·L-1×(9 L+2 L)=0.11 mol
n(SO42—)=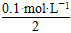 ×2 L=0.1 mol
×2 L=0.1 mol
所以:c(H+)>c(SO42—)>c(Na+)>c(OH-)。
本题难度:一般
2、选择题 下列各组离子一定能大量共存的是
[? ]
A.含有大量Fe3+的溶液中:NH4+、Na+、Cl-、SCN-
B.在强碱溶液中:Na+、K+、AlO2-、CO32-
C.在c(H+)=10-13mol·L-1的溶液中:NH4+、Al3+、SO42-、NO3-
D.在pH=1的溶液中:K+、Fe2+、Cl-、NO3-
参考答案:B
本题解析:
本题难度:一般
3、选择题 在pH=1的无色透明溶液中,不能大量共存的离子组是:
A.Al3+、Ag+、NO3-、I-
B.Mg2+、NH4+、NO3-、Cl-
C.NH4+、K+、S2-、Br-
D.Zn2+、Na+、NO3-、SO42-
参考答案:A、C
本题解析:题目给出两个重要条件:pH=1(即酸性)和无色透明,并要求找出不能大量共存的离子组。选项A中Ag+与I-不能共存,生成黄色的AgI不溶于HNO3(H+和NO3-),Al3+、NO3-、H+都为无色,符合题意。选项B、D中的各离子虽都是无色的,但能共存于酸性溶液中,不符合题意。选项C中各离子能够共存,且为无色,但S2-与H+不能大量共存,所以C也符合题意。
答案:A、C
本题难度:简单
4、选择题 某溶液中含有Na+、NH4+、HCO3-、CO32-、SO32-、CH3COO-等6种离子.若向其中加入足量Na2O2后,溶液中离子浓度基本保持不变的是( )
A.CH3COO-
B.Na+
C.CO32-
D.SO32-
参考答案:A、加入足量过氧化钠,溶液中生成氢氧化钠和氧气,CH3COO--浓度基本不变,故A符合;
B、Na2O2与水反应生成氢氧化钠,溶液呈碱性,Na+浓度增加,故B不符合;
C、HCO3-与OH-反应生成CO32-,则HCO3-离子浓度减小,CO32-离子浓度增大,故C不符合;
D、Na2O2具有强氧化性,将SO32-氧化为SO42-,则SO32-离子浓度减小,故D不符合;
故选A.
本题解析:
本题难度:简单
5、选择题 向一定量的K2CO3溶液中缓慢滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中离子数目也相应地发生变化。如图所示,四条曲线与溶液中的离子的对应关系,完全正确的是?(?)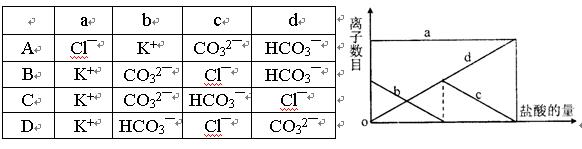
参考答案:C
本题解析:略
本题难度:简单