微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是[? ]
A.CO2的摩尔质量为44g
B.5.4mL4℃的H2O中有1.806×1023个分子
C.标准状况下,2.24L CCl4所含的原子数为0.5NA
D.50mL 1mol/L BaCl2溶液中,Ba2+和Cl-物质的量之和是0.1mol
参考答案:B
本题解析:摩尔质量的单位是g/mol,A不正确;5.4mL4℃的H2O是5.4g÷18g/mol=0.3mol,含有的水分子个数是0.3mol×6.02×1023/mol=1.806×1023个,B正确;标准状况下,四氯化碳不是气体,不能适用于气体摩尔体积,C不正确;50mL 1mol/L BaCl2的物质的量是0.05mol,所以Ba2+和Cl-物质的量之和是0.15mol,D不正确,答案选B。
点评:该题是基础性试题的考查,难度不大。该题学生需要明确的是在进行物质的量的有关计算时,关键是熟练应用几个关系式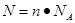 、n=m/M、
、n=m/M、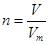 、
、 ,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
,特别还要注意气体摩尔体积的使用条件,即只能适用于气体,且只有在标准状况下,气体的摩尔体积才是22.4L/mol。
本题难度:一般
2、计算题 (10分)实验室在加热条件下制取Cl2的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。现将17.4 g MnO2投入到400 g质量分数为36.5%的浓盐酸(浓盐酸过量)中加热,充分反应后(不考虑盐酸挥发),求:
MnCl2+Cl2↑+2H2O。现将17.4 g MnO2投入到400 g质量分数为36.5%的浓盐酸(浓盐酸过量)中加热,充分反应后(不考虑盐酸挥发),求:
(1)标准状况下生成Cl2的体积为多少? (2)剩余HCl的物质的量为多少?
参考答案:4.48L;3.2mol
本题解析:
试题解析:8.7MnO2的物质的量=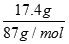 =0.2mol,则:
=0.2mol,则:
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1 4 1
0.2mol n(HCl) n(Cl2)
n(Cl2)=n(MnO2)==0.2mol,V(Cl2)=22.4L/mol×0.2mol=4.48L;(2)原溶液中氯化氢的物质的量= =4mol,反应过程中消耗的氯化氢的物质的量=0.2mol×4=0.8mol,故反应后剩余氯化氢的物质的量=4mol-0.8mol=3.2mol。
=4mol,反应过程中消耗的氯化氢的物质的量=0.2mol×4=0.8mol,故反应后剩余氯化氢的物质的量=4mol-0.8mol=3.2mol。
考点:化学方程式的有关计算
本题难度:一般
3、选择题 将a g锌加到V L c mol·L-1的盐酸中,共放出n L氢气(标准状况下),则被还原的HCl的物质的量是
A.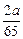 mol?
mol?
B.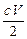 ×10-3 mol?
×10-3 mol?
C.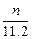 mol?
mol?
D.cV mol?
参考答案:C
本题解析:因为锌跟盐酸反应,从题设条件无法知道Zn、HCl哪个过量,所以只能从生成物H2的量推出被还原的HCl的物质的量。还原的HCl的物质的量为H2的2倍,即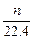 ×2 mol=
×2 mol=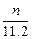 ?mol。C对。
?mol。C对。
本题难度:简单
4、选择题 物质的量浓度相同的下列溶液:①Na2CO3②NaHCO3③H2CO3④(NH4)2CO3⑤NH4HCO3,按c(CO32-)由小到大排顺序正确的是(?)
A.⑤<④<③<②<①
B.③<⑤<②<④<①
C.③<②<⑤<④<①
D.③<⑤<④<②<①
参考答案:B
本题解析:碳酸属于弱酸,溶液的电离度很小,其他物质全部是强电解质,在溶液中全电离,所以碳酸溶液中c(CO32-)最小,Na2CO3和(NH4)2CO3溶液中直接可以电离出CO32所以c(CO32-)较大,但是在(NH4)2CO3溶液中铵根离子的水解会促进碳酸根的水解,使c(CO32-)减小,所以(NH4)2CO3溶液中c(CO32-)小于Na2CO3溶液中c(CO32-),NH4HCO3和NaHCO3会电离出碳酸氢根离子,然后再电离出碳酸根离子,但是铵根的水解会抑制碳酸氢根的电离,所以所以NH4HCO3溶液中c(CO32-)小于NaHCO3溶液中c(CO32-),综上所以答案选B。
本题难度:简单
5、选择题 有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4 mol·L-1,S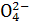 的物质的量浓度为0.7 mol·L-1,则此溶液中K+的物质的量浓度(mol·L-1)约为 ( )
的物质的量浓度为0.7 mol·L-1,则此溶液中K+的物质的量浓度(mol·L-1)约为 ( )
A.0.1
B.0.15
C.0.2
D.0.25