微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应中既属于氧化还原反应又属于放热反应的是(? )。
A.氢氧化钾与硫酸的反应
B.锌与盐酸反应放出氢气
C.镁条在空气中燃烧
D.Ba(OH)2·8H2O与NH4Cl反应
参考答案:BC
本题解析:A是放热反应但不是氧化还原反应;B、C既属于氧化还原反应又属于放热反应;D属于吸热反应但不属于氧化还原反应。
本题难度:一般
2、填空题 (Ⅰ)碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。 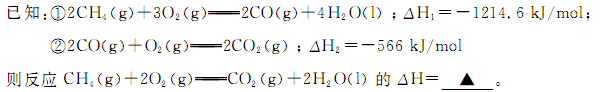
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是:?。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:
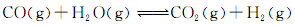 ,得到如下三组数据:
,得到如下三组数据:

①实验1中,以v( H2)表示的平均反应速率为:??。
②该反应的正反应为??(填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是 ?(用含a、b的数学式表示)。
(Ⅱ)某小组运用工业上离子交换膜法制烧碱的原理,用如下图所示装置电解K2SO4溶液。
①该电解槽中通过阴离子交换膜的离子数?(填“>”“<”或“一”)通过阳离子交换膜的离子数;
②图中a、b、c、d分别表示有关溶液的pH,则a、b、c、d由小到大的顺序为 ?;
③电解一段时间后,B出口与C出口产生气体的质量比为?。
参考答案:(Ⅰ)(1) -890.3 kJ/mol?(2分)
(2) CH4 -8e-+10OH - ==CO3 2- +7H2O?(2分)
(3) ①0.16 mol·L-1·min-1 (2分)?②放 (1分)
③a∶b=1∶2(或b=2a)?(2分)
(Ⅱ)①? <?(1分)
② b<a<c<d ?(2分)。?③ 8∶1?(2分)
本题解析:(1)将两个方程式相加再除以2即得所求的反应,故所求反应的ΔH=(ΔH1+ΔH2)/2,带入数值可得ΔH=-890.3 kJ/mol;(2)原电池中负极发生氧化反应,故通入甲烷的一极为负极,甲烷失去电子,在碱性条件下生成碳酸根离子;(3)①根据表格中的CO的起始量和平衡量可得转化量为1.6mol,生成氢气的物质的量为1.6mol,浓度变化量为0.8mol/L,再除以时间5分钟可得0.16 mol·L-1·min-1②温度升高,CO的转化率减小,说明升高温度平衡向左移动,故正反应为放热反应;③若要实验3达到与实验2相同的平衡状态,则只要划归为原比即可,水和一氧化碳的起始值满足1:2,即a:b=1:2;(Ⅱ)①左边消耗2个氢氧根离子需要移动一个硫酸根离子来满足左边溶液的电荷守恒,右边消耗2个氢离子就需要移动2个钾离子来满足溶液电荷守恒,故通过阴离子交换膜的离子数小于通过阳离子交换膜的离子数;②左边接电源的正极,是阳极,在阳极上OH-放电生成氢离子,使pH减小,右边是阴极,在阴极上,氢离子放电生成氢氧根离子使pH增大,故b<a<c<d③根据两极上转移电子数目相等,在阳极上生成的氧气和阴极上生成的氢气的物质的量之比为1:2,质量比为8:1。
本题难度:一般
3、选择题 下列说法正确的是(? )
A.1mol可燃物燃烧生成氧化物放出的热量就是该物质的燃烧热
B.因为醋酸是弱电解质,盐酸是强电解质,所以中和等体积等物质的量浓度的醋酸和盐酸时,中和醋酸消耗的NaOH比盐酸消耗的NaOH用量少
C.反应物总能量大于生成物总能量的反应是放热反应
D.强电解质溶液的导电能力比弱电解质溶液的导电能力强
参考答案:C
本题解析:燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,使用选项A不正确;等体积等物质的量浓度的醋酸和盐酸的物质的量是相等的,因此消耗的氢氧化钠是相等的,B不正确;溶液的导电性只与溶液中自由移动的离子大小有关系,而与电解质的强弱是无关系的,选项D不正确,因此正确的答案选C。
本题难度:一般
4、选择题 热化学方程式 2H2(气) + O2(气) = 2H2O(气),△H=- 483.6 kJ/mol ,其中化学计量(系数)表示的是(?)
A.体积数
B.物质和质量
C.物质的量
D.物质的质量
参考答案:C
本题解析:在热化学方程式中化学计量数表示参加反应的物质的物质的量,答案选C。
点评:该题是基础性试题的考查,试题基础性强,侧重对学生基础知识的巩固与训练,有助于调动学生的学习兴趣,提高学生的学习效率。
本题难度:简单
5、实验题 影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反
应速率的因素。
甲同学研究的实验报告如下表:
实?验?步?骤
| 现?象
| 结?论
|
①分别取等体积的2 mol/L硫酸于试管中;
②分别投入大小、形状相同的Cu、Fe、Mg。
| 反应快慢:
Mg>Fe>Cu
| 反应物的性质越活泼,反应速率越快。
|
(1)该同学的实验目的是________________________________;
要得出正确的实验结论,还需控制的实验条件是________。
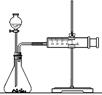
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品是______;应该测定的实验数据是____________________________。
(3)在使用铁与稀硫酸反应制氢气时,实验室里选择粗铁比纯铁效果更好,原因是:?。
参考答案:(1)反应物本身的性质对反应速率的关系;(3分)?温度相同;(2分)
(2)Mg(或Fe)和0.5mol/L硫酸和2mol/L硫酸;(2分)
测定一定时间产生气体的体积(或者测定一定体积的气体所需时间);(2分)
(3)粗铁中含有杂质,铁,杂质和稀硫酸形成原电池,加快反应速率(3分,答到形成原电池即给分)
本题解析:比较金属性强弱可以用金属与酸反应的剧烈程度及置换出氢气的难易程度来比较。因为影响反应速率的外界因素很多,所以在比较金属和酸的剧烈程度及置换氢气的难易程度时,需要控制外界条件相同,因为硫酸的浓度是相同的,所以还应让溶液的温度相同。根据乙同学所用实验装置图可得出,该同学是想利用金属在相同的时间内置换出氢气的多少来比较其金属性强弱的,实验需要测量定时间内产生气体的体积(或产生一定体积的气体所需时间)。因为在常温下铁和浓硫酸发生钝化,所以不能选择浓硫酸。粗铁中含有杂质,在溶液中可以构成原电池加快反应速率。
本题难度:一般