微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是
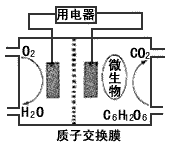
[? ]
A.该电池能够在高温下工作
B.电池的负极反应为: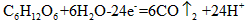
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1mol氧气,理论上能生成标准状况下CO2气体
参考答案:B
本题解析:
本题难度:一般
2、填空题 在Cu-Zn原电池中,200mL H2SO4溶液的浓度为0.125mol/L,若工作一段时间后,从装置中共收集到0.168L升气体,则流过导线的电子为__________mol,溶液的pH值为_________。(溶液体积变化忽略不计,已知lg2=0.3 lg3=0.5)
参考答案:0.015 ;3.2
本题解析:
本题难度:一般
3、简答题 已知:KClO3+6HCl=KCl+3Cl2↑+3H2O,该反应中的氧化剂为______,还原剂为______,参加反应的HCl与被氧化的HCl的质量比______.现取250ml12mol/L的盐酸与一定量的KClO3固体充分反应后,测得放出的气体体积为6.72升(标准状况),此过程转移的电子数为______.若忽略溶液体积变化,反应后溶液中的盐酸的物质的量浓度为______mol/L.取100ml该溶液能与______克NaOH固体恰好反应完全.
参考答案:反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,只有Cl元素化合价发生变化,其中KClO3为氧化剂,HCl为还原剂,HCl在反应中表现为酸性和还原性,由方程式可知当有6molHCl参加反应时,有5mol被氧化,则参加反应的HCl与被氧化的HCl的质量比6:5,
由方程式可知当生成3molCl2时,转移5mol电子,现取250ml12mol/L的盐酸与一定量的KClO3固体充分反应后,测得放出的气体体积为6.72升(标准状况),n(Cl2)=6.72L22.4L/mol=0.3mol,则转移0.5mol电子,
则此过程转移的电子数为0.5mol×6.02×1023/mol=3.01×1023,
反应后剩余HCl的物质的量为0.25L×12mol/L-0.6mol=2.4mol,
则反应后的物质的量浓度为2.4mol0.25L=9.6mol/L,
100mL时,n(HCl)=0.1L×9.6mol/L=0.96mol,
需要0.96molNaOH溶液,m(NaOH)=0.96mol×40g/mol=38.4g,
故答案为:KClO3;HCl;6:5;3.01×1023;9.6;38.4.
本题解析:
本题难度:一般
4、选择题 火法炼铜首先要焙烧黄铜矿,其反应为:2CuFeS2+O2=Cu2S+2FeS+SO2,下列说法不正确的是
A.SO2既是氧化产物又是还原产物
B.CuFeS2既作还原剂也作氧化剂,硫元素被氧化
C.每生成1 molCu2S,有4mol硫被氧化
D.每转移1.2 mol电子,有0。2 mol硫被氧化
参考答案:C
本题解析:试题分析:A、正确;B、CuFeS2中铜铁均为+2价,硫为-2价,铜化合价降低,硫化合价升高,故CuFeS2既作还原剂也作氧化剂,硫元素被氧化,正确;C、每生成1 molCu2S,有1mol硫被氧化,错误;D、每个硫原子化合价变化6,故每转移1.2 mol电子,有0。2 mol硫被氧化,正确。
考点:考查氧化还原反应的有关概念、电子转移等有关问题。
本题难度:简单
5、选择题 向淀粉溶液中加入少量稀H2SO4,加热,使淀粉水解,为测定其水解程度,需要加入的试剂是
①NaOH溶液?②银氨溶液?③新制碱性Cu(OH)2悬浊液?④碘水
A.④
B.②④
C.①③④
D.③④
参考答案:C
本题解析:淀粉在一定条件下水解程度可能有三种情况:(1)水解完全,产物为葡萄糖;(2)部分水解,体系中有葡萄糖和没水解的淀粉等;(3)淀粉没水解(体系中无葡萄糖)。由于反应中H2SO4仅起催化作用,故反应后体系中的H2SO4需用NaOH溶液中和之。淀粉的检验需用碘水(变蓝色)。葡萄糖的检验需用银氨溶渡或新制碱性Cu(OH)2。即试剂组合为①②④或①③④。
本题难度:困难