微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列反应的离子方程式正确是( )
A.溴化亚铁溶液中通人少量氯气:2Br-+Cl2=Br2+2Cl-
B.实验室氯化铁溶液制取氢氧化铁胶体:Fe3++3H2O
Fe(OH)3(胶体)+3H+
C.硫酸铜溶液中加入氢氧化钡溶液:Ba2++SO42-=BaSO4↓
D.用湿润的醋酸铅试纸检验H2S:Pb2++H2S=PbS↓+2H+
参考答案:A.溴化亚铁溶液中通人少量氯气的离子反应为2Fe2++Cl2=2Fe3++2Cl-,故A错误;
B.实验室氯化铁溶液制取氢氧化铁胶体的离子反应为Fe3++3H2O△.Fe(OH)3(胶体)+3H+,故B正确;
C.硫酸铜溶液中加入氢氧化钡溶液的离子反应为Cu2++2OH-+Ba2++SO42-=BaSO4↓+Cu(OH)2↓,故C错误;
D.用湿润的醋酸铅试纸检验H2S的离子反应为Pb(CH3COO)2+H2S=PbS↓+2CH3COOH,故D错误;
故选B.
本题解析:
本题难度:一般
2、选择题 下列表示对应化学反应的离子方程式正确的是
A.漂白粉溶液在空气中失效: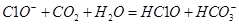
B.浓盐酸与MnO2反应制取氯气: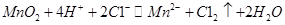
C.醋酸溶液与水垢中的Mg(OH)2反应: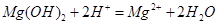
D.向NH4HCO3溶液中加过量的NaOH溶液并加热: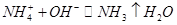
参考答案:B
本题解析:A不正确,生成物应该是碳酸钙和次氯酸;醋酸是弱酸,应该用化学式表示,C不正确;D中氢氧化钠过量,还生成碳酸钠,因此答案选B。
本题难度:简单
3、选择题 下列离子方程式不正确的是
[? ]
A.氢氧化钡溶液滴加盐酸:H+ + OH- = H2O
B.红色的氧化铁粉末溶于盐酸:O2- + 2H+ = H2O
C.小苏打溶液与氢氧化钠溶液混合:HCO3- + OH- =CO32- +H2O
D.石灰石中加入盐酸:CaCO3 + 2H+=Ca2+ + H2O + CO2↑
参考答案:B
本题解析:
本题难度:一般
4、选择题 下列离子方程式正确的是( )
A.澄清石灰水与稀盐酸反应:Ca(OH)2+2H+═Ca2++2H2O
B.钠与水反应:Na+2H2O═Na++2OH-+H2↑
C.铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag
D.大理石溶于醋酸的反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O
参考答案:A.澄清石灰水是氢氧化钙的溶液,在离子反应方程式中应该拆写成离子,澄清石灰水与稀盐酸反应离子反应方程式为OH-+H+═H2O,故A错误;
B.钠与水反应:Na+2H2O═Na++2OH-+H2↑方程式左右电荷不守恒,正确的离子反应方程式为2Na+2H2O═2Na++2OH-+H2↑,故B错误;
C.铜片插入硝酸银溶液中:Cu+Ag+═Cu2++Ag,方程式左右电荷不守恒,正确的离子反应方程式为Cu+2Ag+═Cu2++2Ag,故C错误;
D.大理石的主要成分为碳酸钙,碳酸钙难溶于水,在离子反应方程式中写化学式,醋酸是弱酸,在离子反应方程式中写化学式,大理石溶于醋酸的反应:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O,故D正确;
故选:D.
本题解析:
本题难度:简单
5、简答题 硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低.现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出.在反应结束后的溶液中,逐滴加入4mol?L-1NaOH溶液.所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如图所示:
(1)和铝粉和铁粉的混合物反应时,HNO3对应还原产物为______(填化学式);
(2)完成下列过程中的离子反应方程式:
O→C______;D→E______;E→F______;
(3)B值是多少mol?写出计算过程.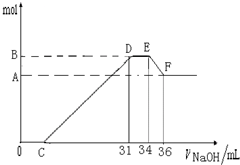
参考答案:(1)HNO3的还原产物有N2O,NO,NO2,NH4+等,其中,铵根可以保留在溶液中,且可以与氢氧化钠反应,D与E一段氢氧化钠被消耗,但没有和氢氧化铝反应,从题干中可以知道,硝酸反应没有气体产生,由此可以肯定还原产物为硝酸铵.
故答案为:NH4NO3;
(2)O→C 之间没有沉淀生成,说明硝酸过量,O→C 之间发生的反应酸碱中和反应,离子方程式为H++OH-═H2O,
D与E一段沉淀的质量没有发生变化,为NH4NO3和NaOH反应,反应的离子方程式为,NH4++OH-═NH3?H2O,
E与F之间沉淀的量减少,肯定是因为Al(OH)3溶解在氢氧化钠溶液中,反应的离子方程式为Al(OH)3+OH-=AlO2-+2H2O
故答案为:H++OH-═H2O;NH4++OH-═NH3?H2O;Al(OH)3+OH-=AlO2-+2H2O;
(3)E与F之间沉淀的量减少,为Al(OH)3溶解在氢氧化钠溶液中,
其反应方程式为Al(OH)3+NaOH=NaAlO2+2H2O,
氢氧化铝与氢氧化钠物质的量之比为1:1,
EF段的n(NaOH)=4mol/L×2×10-3L=0.008mol,
Al(OH)3+NaOH→NaAlO2+2H2O
1?mol? 1mol
0.008?mol? 0.008mol
Al(OH)3的量是0.008mol,所以Al3+也是0.008mol.
所以B与A差值为0.008mol
然后看D与E一段氢氧化钠被消耗,
但没有和氢氧化铝反应,从题干中可以知道
硝酸反应没有气体产生,由此可以肯定还原产物为硝酸铵.
DE段分析如下,是NH4NO3和NaOH反应
NH4NO3~NaOH
1 mol?1mol
n(NH4NO3)=n(NaOH)=(34-31)×10-3L×4mol/L=0.012mol 所以铁和铝开始和硝酸反应的时候生成三价离子,N元素变成铵根离子
铁离子和铝离子失去3e,N元素从+5变成-3价得8e
设铁有xmol,Al离子也是0.008mol,NH4+有0.012mol,根据电子守恒可得:
3x+0.008×3=0.012×8
x=0.024mol,
所以铁离子有0.024mol,那么氢氧化铁有0.024mol,氢氧化铝0.008mol,
则沉淀量最多的时候是0.032mol,
答:B值是0.032mol.
本题解析:
本题难度:一般