微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 FeCl3和CuCl2的混合液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是
[? ]
A.加入KSCN溶液一定不变红色
B.溶液中一定含Fe2+
C.溶液中不一定含Cu2+
D.剩余固体中不一定含Cu
参考答案:D
本题解析:
本题难度:简单
2、选择题 将3.2 gCu投入到一定浓度的HNO3溶液中,恰好完全反应,产生NO2和NO的混合气体共 0.08 mol。则原溶液中HNO3的物质的量为
参考答案:A.0.34 mol?B.0.38 mol? C.0.28 mol?D.0.18 mol? ?高#
本题解析:D
本题难度:简单
3、选择题 下列叙述正确的是
[? ]
A.不溶于水的氧化铁、氧化亚铁都是碱性氧化物,因此都能溶于盐酸中
B.氯化铁、氯化亚铁溶液都是黄色的盐溶液,滴加氢氧化钠溶液均产生红褐色沉淀
C.氢氧化铁、氢氧化亚铁都是难溶性碱,均可溶于强酸又可溶于强碱
D.含Fe3+的溶液中滴入KSCN溶液,立即出现红色沉淀
参考答案:A
本题解析:
本题难度:简单
4、选择题 在FeCl2、CuCl2和FeCl3的混合溶液中加入铁粉,充分反应后,滤出的不溶物中除铜粉外,还有少量铁粉则滤液中
[? ]
A.肯定有Fe2+,可能有Fe3+
B.肯定有Fe3+,一定没有Cu2+
C.肯定有Cu2+,一定没有Fe3+
D.肯定有Fe2+,一定没有Fe3+和Cu2+
参考答案:D
本题解析:
本题难度:一般
5、填空题 铁及其化合物在生活、生产中有着广泛的应用。
Ⅰ.铁触媒(+2价铁和+3价铁组成的氧化物)是工业合成氨的催化剂。某学习小组用下列流程测定铁触媒的含铁量。根据题意回答相关问题:
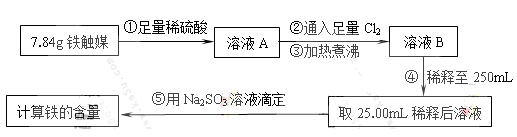
(1)步骤①中需用1.50 mol·L-1的硫酸100mL,若用18.4mol·L-1的浓硫酸来配制,则需要用量筒量取浓硫酸?mL
(2)步骤②通入Cl2的目的是?(用离子方程式表示)
(3)步骤④后需用?(填仪器名称)取25.00mL稀释后溶液。
(4)步骤⑤消耗0.10mol·L-1的Na2SO3溶液25.00mL,则铁触媒中铁的质量分数为?。
Ⅱ.目前的研究表明,铁的某些含氧酸盐可用于工业废水、废气的处理。
(1)用K2FeO4处理中性废水时与水反应生成氢氧化铁胶体,并放出无色无味的气体和其它物质,写出反应的离子反应方程式?,处理废水时既利用K2FeO4强氧化性,又利用生成氢氧化铁胶体的?作用。
(2)MFe2O4可以与氢气反应制备新型纳米材料氧缺位铁酸盐MFe2Ox (3<x<4),其中M表示+2价的金属元素,常温下,MFe2Ox能使工业废气中的SO2转化为S,达到回收硫、净化空气目的,转化过程表示如下:
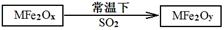
则可以判断x?y,氧化性:MFe2Oy?SO2(填“>”、“<”或“=”)
参考答案:Ⅰ.(1)8.2(2)2Fe2++Cl2=2Fe3++2Cl-(3)酸式滴定管(或移液管)?(4)35.7%
Ⅱ.(1)4FeO42-+ 10H2O = 4Fe(OH)3(胶体) +8OH- + 3O2↑;聚沉(或吸附)(2)<;<.
本题解析:Ⅰ.在溶液稀释前后溶质的物质的量不变,利用稀释公式C1V1=C1V2可得1.50 mol·L-1×100m=18.4mol·L-1×Vml,解得V="8.2ml." (2)步骤②通入Cl2的目的是把亚铁离子氧化为铁离子,离子方程式是2Fe2++Cl2=2Fe3++2Cl-(3)氯化铁溶液显酸性要用移液管或酸式滴定管来量取,防止腐蚀碱式滴定管的橡胶管。(4)2Fe3++SO32-+H2O=2Fe2+SO42-+2H+可利用铁离子与亚硫酸根离子的关系求解得到原来的固体中含有铁的总物质的量为0.05mol,质量为0.05mol×6g/mol=2.8g.所以在铁触媒中铁的质量分数为2.8g/7.84g×100℅=35.7%.Ⅱ.K2FeO4有强的氧化性,能杀菌、消毒,它本身被还原为铁离子,铁离子在溶液中水解产生氢氧化铁胶体,氢氧化铁胶体吸附水中的悬浮物使之变为沉淀,从而达到净化水的目的。K2FeO4处理中性废水时与水反应的离子方程式为:4FeO42-+ 10H2O = 4Fe(OH)3(胶体) +8OH- + 3O2↑
本题难度:一般