向混合液中加入浓溴水,充分反应后,过滤
参考答案:A
本题解析:A、水中羟基的氢原子活泼性强于乙醇分子中羟基氢原子的活泼性,乙醇比较水和乙醇中羟基氢的活泼性强弱可以用金属钠分别与水和乙醇反应,A正确;B、丙烯醛分子中的碳碳双键和醛基均被酸性高锰酸钾溶液氧化,所以不能用滴入酸性KMnO4溶液,看紫红色是否褪去来证明CH2=CHCHO中含有碳碳双键,B不正确;C、确定碳、氯两元素非金属性的强弱,应该测定同温同浓度的Na2CO3和NaClO4水溶液的pH,C不正确;D、苯酚能与浓溴水反应,但生成的三溴苯酚又溶解在苯中,因此欲除去苯中混有的苯酚应该用氢氧化钠溶液,D不正确,答案选A。
本题难度:一般
3、实验题 (9分)硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得。实验室模拟该工业过程的装置如图所示。
回答下列问题:

(1)b中反应的离子方程式为__________________,c中试剂为_____________________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是____________________。
(3)d中的试剂为____________。
(4)实验中要控制SO2生成速率,可以采取的措施有______________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是_______________________。
参考答案:(1)SO32-+2H+= H2O +SO2↑;或HSO3-+H+=SO2↑+H2O;硫化钠和碳酸钠的混合溶液
(2)硫(3)NaOH溶液?(4)控制反应温度、调节酸的滴加速度(或调节酸的浓度等)
(5)若SO2过量,溶液显酸性,产物分解
本题解析:(1)装置b是制取SO2的装置。在b中反应的离子方程式为SO32-+2H+= H2O +SO2↑;或HSO3-+H+=SO2↑+H2O;根据反应原理可知在c中的试剂是硫化钠和碳酸钠的混合溶液。(2)反应开始后,c中先发生反应:H2O+SO2+Na2S=H2S+ Na2SO3; SO2+2H2S="3S↓+" 2H2O.S是不溶于水的淡黄色物质。因此有浑浊产生,后又变澄清,发生反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2。(3) H2S 、SO2都是大气污染物。由于它们都是酸性气体,能够与碱发生反应,所以在d中的试剂为强碱NaOH溶液。为防止倒吸现象的发生,在导气管的末端安装了一个干燥管。(4)影响化学反应速率的因素的因素有浓度、温度、滴加速度等。在实验中要控制SO2生成速率,可以采取的措施有控制反应温度、调节酸的滴加速度或调节酸的浓度等。(5)硫代硫酸钠( Na2S2O3)是强碱弱酸盐,与酸容易发生反应。所以若SO2过量,溶液显酸性,产物容易分解。因此不能过量。
本题难度:一般
4、选择题 下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组是( )
A.Ba(OH)2,KSCN,NaCl,Mg(NO3)2,(FeCl3溶液)
B.NaNO3,NaHCO3,(NH4)2SO3,Na2SiO3,(H2SO4溶液)
C.NH4Br,K2CO3,NaI,CaCl2,(AgNO3溶液)
D.NH4NO3,NaBr,CuSO4,AlCl3,(KOH溶液)
参考答案:A.Ba(OH)2与FeCl3反应生成红褐色沉淀,KSCN与FeCl3反应溶液变为红色,然后用Ba(OH)2鉴别NaCl、Mg(NO3)2,产生沉淀的是Mg(NO3)2,故A正确;
B.NaNO3与H2SO4不反应,无现象,NaHCO3与H2SO4反应生成无色无味的气体,(NH4)2SO3与H2SO4反应生成有刺激性气味的气体,Na2SiO3与H2SO4反应生成难溶的沉淀,现象各不相同,故B正确;
C.AgNO3溶液无法鉴别K2CO3和CaCl2,二者都产生白色沉淀,故C错误;
D.NH4Cl与KOH反应生成刺激性气体氨气,NaBr与KOH不反应,无现象,CuSO4与KOH反应生成蓝色Cu(OH)2沉淀,AlCl3加入KOH溶液后先生成Al(OH)3沉淀后溶解,现象各不相同,故D正确.
故选C.
本题解析:
本题难度:简单
5、选择题 下图所示的实验方法、装置或操作完全正确的是
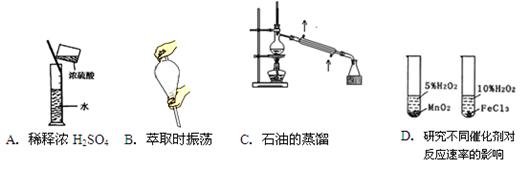 ? ?
参考答案:C
本题解析:略
本题难度:一般
|