微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A、B、C、D、E五瓶透明溶液,分别是HCl,BaCl2,NaHSO4,Na2CO3,AgNO3中的一种.
①A与B反应有气体生成;②B与C反应有沉淀生成;③C与D反应有沉淀生成;④D与E反应有沉淀生成;⑤A与E反应有气体生成;⑥在②和③的反应中生成的沉淀是同一种物质.请填空:
(1)在②和③的反应中,生成的沉淀物质的化学式(分子式)是______.
(2)A是______;B是______;C是______;D是______;E是______.
参考答案:根据信息①⑤反应有气体,气体只能为CO2,则A为Na2CO3,
其余,先分组:B、E组为HCl、NaHSO4,那么C、D组为AgNO3、BaCl2,
据信息⑥知产生的沉淀为AgCl,所以C物质为AgNO3,结合其他信息知E为NaHSO4,D为BaCl2,B为HCl,
(1)反应③为AgNO3和BaCl2的反应,生成AgCl沉淀,故答案为:AgCl;
(2)由以上分析可知A为Na2CO3,B为HCl,C为AgNO3,D为BaCl2,E为NaHSO4,故答案为:Na2CO3;HC1;AgNO3;BaCl2;NaHSO4.
本题解析:
本题难度:一般
2、填空题 (12分)在一定条件下,某些化学反应可以下图框架表示,根据要求回答下列问题:
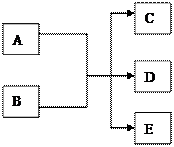
(1)若A、C、D均为含氯物质,且A的化合价介于C和D之间,D具有漂白性,写出该反应的离子方程式?;
(2)若通过电解的方法获得黄绿色气体C,则该反应的离子方程式为? ?
?
(3)若C、D均为气体且均能使澄清石灰水变浑浊,写出符合上述框图要求的化学方程式?
(4)若C是一种极易溶于水的气体,D是一种常见的干燥剂,写出A和B反应的化学方程式
(5)若A为红色金属单质,B为第二周期某种元素的最高价氧化物的水化物,写出符合上述框图关系的离子方程式 (写出符合要求的一个即可)。
(6)若C是食盐溶液,D是一种白色胶状沉淀,E是一种能产生温室效应的气体,写出符合上述框图关系的离子方程式 (写出符合要求的一个即可)。
参考答案:

本题解析:略
本题难度:一般
3、推断题 A—J均为中学化学中常见物质,C、D、G、H、I常温下均为气体,且G为单质,C常参加光合作用,其中H和I为大气污染物,E为常见的无色液体。F的焰色反应为黄色,反应①、②、③为工业反应。固体A是一种化肥,产物C、D、E的物质的量之比为1:1:1。它们之间的转化关系如下图:

(1)写出A的化学式?,B的电子式为?,B中含有的化学键类型是?。
(2)写出反应①的化学方程式?。
(3)少量J溶液加入F的水溶液中发生反应的离子方程式为?。
(4)氯气遇到D会产生大量白烟,常用D的浓溶液检验氯气管道是否漏气。其发生反应化学方程式为?。
(5)将G和I的混合气体60 mL通入水中,充分反应后余下气体10 mL(在相同条件下测定),则混合气体中G和I的体积比为?。
参考答案:(1)NH4HCO3(1分), 、 离子键、共价键(或非极性共价键)(4分)
、 离子键、共价键(或非极性共价键)(4分)
(2)4NH3 + 5O2 4NO + 6H2O (2分)?(3)CO32- + H+= HCO3-(2分)
4NO + 6H2O (2分)?(3)CO32- + H+= HCO3-(2分)
(4)8NH3 + 3Cl2= 6NH4Cl? +? N2?(2分)?(5)1:2或1:9(3分)
本题解析:C是气体,常参加光合作用,这说明C是CO2。F的焰色反应为黄色,说明含有钠元素。固体B和CO2反应生成F和G,G是单质,这说明B可能是过氧化钠,F是碳酸钠,G是氧气。E为常见的无色液体,则E应该是水。氧气能和D反应生成H,H和氧气又可以继续反应生成I,且I可以和水反应生成H和L。又因为H和I为大气污染物,这说明D应该是氨气,H是NO,I是NO2,L是硝酸。固体A是一种化肥,产物C、D、E的物质的量之比为1:1:1,所以是碳酸氢铵。
(1)A的化学式是NH4HCO3,过氧化钠中含有离子键和非极性键,电子式是 。
。
(2)反应①是氨气的催化氧化,化学方程式是4NH3 + 5O2 4NO + 6H2O。
4NO + 6H2O。
(3)硝酸不足,和碳酸钠反应生成碳酸氢钠,反应的离子方程式是CO32- + H+= HCO3-。
(4)氯气遇到D会产生大量白烟,这说明反应中有氯化铵生成,因此该反应是氧化还原反应,方程式是8NH3 + 3Cl2= 6NH4Cl + N2。
(5)如果反应中剩余的气体是氧气,则根据方程式可知
4NO2+O2+2H2O=4HNO3
4x? x
所以4x+x+10=60
解得x=10
因此混合气体中G和I的体积比为20:40=1:2
如果剩余的气体是NO,则根据方程式可知
4NO2+O2+2H2O=4HNO3
4y? y
3NO2+H2O=2HNO3+NO
30? 10
所以4y+y+30=60
解得y=6
因此混合气体中G和I的体积比为6:54=1:9
点评:该题综合性强,难度较大,主要是考查了物质转化关系的应用和物质性质的应用,主要考查电子式、化学键、化学方程式、离子方程式的书写、NO2和氧气溶于水的计算分析判断。该类试题需要注意的是化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等
本题难度:一般
4、填空题 如图所示反应I、反应II和反应III均是工业生产中常见的反应.其中A、B为化合物,C是温室气体之一,D和K均可用做干燥剂,H常温下为液态化合物,J是一种具有漂白作用的盐,反应III和E与G反应的原理相同.
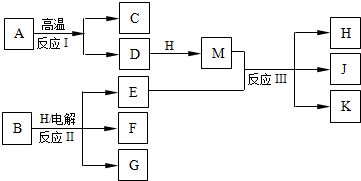
(1)C的电子式是______.
(2)反应II的离子方程式是______.
(3)J久置后,即便不接触水、空气,本身也逐渐分解生成K,并放出气体,该反应的化学方程式是______.
(4)工业上测定反应III产品的有效成分J的含量,先将一定量的产品的溶液加入过量的KI溶液和稀硫酸中,使之反应生成I2,然后用Na2S2O3标准溶液滴定I2,计算出结果.
①用Na2S2O3标准溶液滴定I2时选用的指示剂是______.
②生成I2的反应的离子方程式是______.
(5)已知:2Fe2++Br2=2Fe3++2Br-.若将0.1mol?E通入100mL?FeBr2溶液中,溶液中有三分之一的Br-被氧化成Br2,则此反应离子方程式是______,原FeBr2溶液的物质的量浓度为______.
参考答案:反应I、反应II和反应III均是工业生产中常见的反应,A、B为化合物,C是温室气体之一为CO2,D和K均可用做干燥剂结合反应条件判断为D为CaO,A为CaCO3,H常温下为液态化合物推断为H2O,M为Ca(OH)2,J是一种具有漂白作用的盐推断为Ca(ClO)2,K为CaCl2,E为Cl2,反应III和E与G反应的原理相同,说明G为碱,结合反应条件,可以推断B为NaCl,电解溶液反应生成产物G为NaOH,F为H2;
(1)C为CO2,电子式为:

;故答案为:

;
(2)反应Ⅱ是电极饱和食盐水的反应,反应的离子方程式为:2Cl-+2H2O?电解?.?2OH-+H2↑+Cl2↑;
故答案为:2Cl-+2H2O?电解?.?2OH-+H2↑+Cl2↑;
(3)J(Ca(ClO)2)久置后,即便不接触水、空气,本身也逐渐分解生成K(CaCl2),并放出气体氧气,该反应的化学方程式:Ca(ClO)2=CaCl2+O2↑,故答案为:Ca(ClO)2=CaCl2+O2↑;
(4)①碘单质遇淀粉溶液变蓝;用Na2S2O3标准溶液滴定I2时选用的指示剂为淀粉,随着Na2S2O3标准溶液的滴入,蓝色褪去;故答案为:淀粉;
②生成I2的反应的离子方程式为:ClO-+2I-+2H+=Cl-+I2+H2O;
故答案为:ClO-+2I-+2H+=Cl-+I2+H2O;
(5)若将0.1mol E(Cl2)通入100mL FeBr2溶液中,溶液中有三分之一的Br-被氧化成Br2;溶液中Fe2+的还原性大于Br-的还原性;通入氯气会先氧化Fe2+离子,反应完全后再氧化Br-;
设FeBr2溶液溶液浓度为x,含Fe2+物质的量为0.1xmol;含Br-物质的量为0.2mol;Cl2物质的量为0.1mol;依据溶液中有三分之一的Br-被氧化成Br2得到;
Cl2+2Br-=Br2+2Cl-;
1? 2
0,1x3? 13×0.2x
则与亚铁离子反应的氯气物质的量=0.1mol-0.1x3
? ?Cl2 +2Fe2+=2Fe3++2Cl-;
? 1?2
0.1mol-0.1x3? 0.1x
列式计算得到x=1.2mol/L;
反应的各粒子物质的量为:n(Cl2)=0.1mol;n(Fe2+)=0.12mol;n(Br-)=0.08mol;
n(Cl2):n(Fe2+):n(Br-)=0.1:0.12:0.08=5:6:4;
故反应的离子方程式:6Fe2++4Br-+5Cl2═6Fe3++2Br2+10Cl-
故答案为:6Fe2++4Br-+5Cl2═6Fe3++2Br2+10Cl-1.2?mol/L
本题解析:
本题难度:一般
5、推断题 几种中学化学常见的单质及其化合物相互转化的关系如下图所示
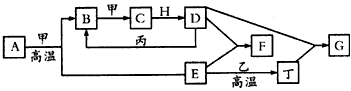
可供参考的信息有:
①甲、乙、丙、丁为单质,其余为化合物。
②A由X和Y两种元素组成,其原子个数比为1:2,元素质量之比为7:8。
③B常温下为无色有刺激性气味的气体,H常温下为无色无味的液体,E常用作红色油漆和涂料。
试根据上述信息回答下列问题:
(1)A的化学式为________。
(2)F与丁单质也可以化合生成G,试写出该反应的离子方程式:____________________。
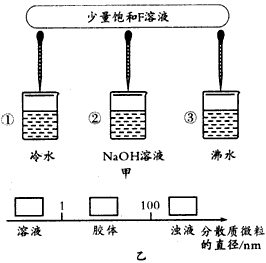
(3)如图甲所示,将少量F的饱和溶液分别滴加到下列物质中,得到三种分散系①、②、③。试将①②③填入图乙方框中。
(4)化合物M与H组成元素相同,可以将G氧化为F,且不引入新的离子。试写出M在酸性环境下将G氧化为F的离子方程式:____________________。
(5)已知丙单质与D的浓溶液按物质的量之比为1:2恰好反应生成B气体的化学转化式为:
丙+D(浓) B↑+ 丙的氧化产物+水,则丙在其氧化产物中的化合价为_________
B↑+ 丙的氧化产物+水,则丙在其氧化产物中的化合价为_________
参考答案:(1) FeS2
(2)2Fe3++Fe=3Fe2+(3) (4)H2O2+2H++2Fe2+= 2Fe3++2H2O
(4)H2O2+2H++2Fe2+= 2Fe3++2H2O
(5) +2价或+4价
本题解析:
本题难度:一般