微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (10分)NO2和N2O4混合气体的针管实验是高中化学的经典素材。理论估算和实测发现,混合气体体积由V压缩为V/2,温度由298K升至311K。已知这两个温度下N2O4(g)  2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
2NO2(g)的压力平衡常数Kp分别为0.141和0.363。
6-1 通过计算回答,混合气体经上述压缩后,NO2的浓度比压缩前增加了多少倍。
6-2 动力学实验证明,上述混合气体几微秒内即可达成化学平衡。压缩后的混合气体在室温下放置,颜色如何变化?为什么?
参考答案:(10分)
6-1
⑴设混合气体未被压缩,在298K(V1、T1)达平衡,N2O4(g)的平衡分压为p1,NO2(g)的平衡分压为p2,则
p1 + p2 =" 1atm?" (a)
KP(298K) = (p2/p?)2/(p1/p?) =" 0.141?" (b)
解联立方程(a)和(b),得:
p1 =" 0.688" atm,? p2 =" 0.312" atm
⑵设针管压缩未发生平衡移动,已知pT1 = 1atm,T1 = 298K,T2 = 311K,V2/V1 = 1/2,根据理想气体状态方程pT1 V1/ T1 = pT2 V2/ T2,解得:
pT2 =" 2.087" atm,N2O4(g)的分压p1 =" 1.436" atm,NO2的分压p2 =" 0.651" atm
⑶压缩引发压力变化,QP = 0.6512/1.436 =" 0.296" < 0.363 = KP(311K),平衡正向移动。设达到平衡时N2O4(g)分压减小x atm,则NO2的分压增加2x atm,有:
KP(311K) = [(p2 +2x)/p?]2/[(p1-x)/p?] =" 0.363?" (c)
解得:x =" 0.0317" atm。
N2O4(g)的平衡分压p1(311K) =" 1.404" atm,NO2(g)的平衡分压为p2(311K) ="0.714" atm
⑷浓度比等于分压比:p2(311K)/ p2(298K) =" 0.714/0.312" = 2.29,增加了1.29倍。
6-2 压缩后的混合气体在室温下放置,温度逐渐下降,平衡象放热方向移动,NO2聚合成N2O4,颜色逐渐变浅,直到体系温度降至室温,颜色不再变化。
本题解析:略
本题难度:困难
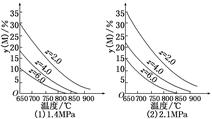
2、选择题 反应aM(g)+bN(g)  ?cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是( )
?cP(g)+dQ(g)达到平衡时,M的体积分数y(M)与反应条件的关系如图所示.其中z表示反应开始时N的物质的量与M的物质的量之比.下列说法正确的是( )
A.同温同压同z时,加入催化剂,平衡时Q的体积分数增加
B.同压同z时,升高温度,平衡时Q的体积分数增加
C.同温同z时,增加压强,平衡时Q的体积分数增加
D.同温同压时,增加z,平衡时Q的体积分数增加
参考答案:B
本题解析:可逆反应中,催化剂只能改变化学反应速率,A错;由两个图象可知,M的体积分数随着温度升高而降低,即温度升高,平衡右移,故平衡时生成物Q的体积分数增加,B正确;同为650℃、z=2.0,压强为1.4 MPa时,y(M)=30%,而压强为2.1 MPa时,y(M)=35%,即增大压强,平衡左移,故平衡时Q的体积分数减小,C错;由图象可知,同温、同压时,若N的物质的量增加,而M的物质的量不变,则尽管z越大,y(M)减小,平衡右移,但Q增加的物质的量远小于加入的N的物质的量,此时Q的体积分数减小,D错。
本题难度:一般
3、选择题 将E和F加入密闭容器中,在一定条件下发 91ExAm.org生反应:E(g)+F(s)  2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示:
压强/MPa
体积分数/%
温度/℃
| 1.0
| 2.0
| 3.0
|
810
| 54.0
| a
| b
|
915
| c
| 75.0
| d
|
1 000
| e
| f
| 83.0
|
?
① b<f ② 915℃、2.0 MPa时E的转化率为60%③ 增大压强平衡左移 ④ K(1 000℃)>K(810℃)
上述①~④中正确的有( )
A.4个? B.3个? C.2个? D.1个
参考答案:A
本题解析:a与b、c与d、e与f之间是压强问题,随着压强增大,平衡逆向移动,G的体积分数减小,b<a;c>75%,e>83%;c、e是温度问题,随着温度升高,G的体积分数增大,所以正反应是一个吸热反应,所以,K(1 000℃)>K(810℃);f的温度比b的高,压强比b的小,所以f>b。而②,可以令E为1 mol,转化率为α,则有2α/(1+α)=75%,α=60%,正确。该反应是一个气体分子数增大的反应,增大压强平衡左移,所以③正确。因为该反应正向吸热,升高温度平衡正向移动,平衡常数增大,故④正确。
本题难度:一般
4、选择题 从下列事实,不能用勒夏特列原理解释的是?(? )
A.在溴水中存在如下平衡:Br2+H2O  HBr+HBrO当加入NaOH溶液后颜色变浅
HBr+HBrO当加入NaOH溶液后颜色变浅
B.对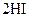

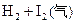 平衡体系增加压强使颜色变深
平衡体系增加压强使颜色变深
C.反应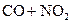
 CO2+NO△H<0升高温度使平衡向逆方向移动
CO2+NO△H<0升高温度使平衡向逆方向移动
D.合成氨反应:

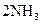 ,△H<0 为使氨的产率提高,理论上应采取低温高压的措施
,△H<0 为使氨的产率提高,理论上应采取低温高压的措施
参考答案:B
本题解析:略
本题难度:简单
5、填空题 将一定量的SO2和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应: (正反应放热)。反应达到平衡后,将容器中的混合气体通入过量NaOH溶液,气体体积减少了21. 28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
(正反应放热)。反应达到平衡后,将容器中的混合气体通入过量NaOH溶液,气体体积减少了21. 28 L;再将剩余气体通过焦性没食子酸的碱性溶液吸收O2,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)
请回答下列问题:
(1)判断该反应达到平衡状态的标志是__________。(填字母)
a.SO2和SO3浓度相等
b.SO2百分含量保持不变
c.容器中气体的压强不变
d.SO3的生成速率与SO2的消耗速率相等
e.容器中混合气体的密度保持不变
(2)欲提高SO2的转化率,下列措施可行的是___________(填字母)
a.向装置中再充入N2
b.向装置中再充入O2
c.改变反应的催化剂
d.升高温度
(3)求该反应达到平衡时SO2的转化率(用百分数表示)。
(4)若将平衡混合气体的5%通入过量的BaCl2溶液,生成沉淀多少克?
|
参考答案:(1)be
(2)b
(3)94.7%
(4)10.5g
本题解析:
本题难度:一般