微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前,用超临界CO2(其状态介于气态和液态之间)代替氟利昂作冷剂已成为一种趋势,这一做法对环境的积极意义在于__________________________。
(2)将CO2转化成有机物可有效实现碳循环。CO2转化成有机物的例子很多,如
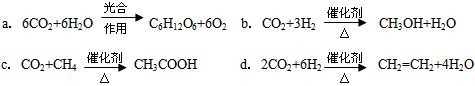
以上反应中,最节能的是_______________,原子利用率最高的是__________________。
(3)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:
在体积为1L的密闭容器中,充入1molCO2和3molH2,一定条件下发生反应:
CO2(g)+3H2(g)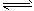 CH3OH(g)+H2O(g)△H=-49.0kJ/mol 测得CO2和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-49.0kJ/mol 测得CO2和CH3OH(g)的浓度随时间变化如图所示。
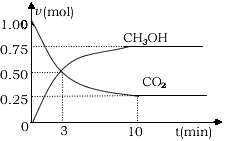
①从反应开始到平衡,氢气的平均反应速率v(H2)=_________mol/(L·min)
②该反应的平衡常数表达式为_________,升高温度,平衡常数的数值将_________(填“增大”、“减小”或“不变”)。
③下列措施中能使n(CH3OH)/n(CO2)增大的是_____________.
A.升高温度
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.再充入1molCO2和3molH2
(4)氢气是合成氨的重要原料,合成氨反应的热化学方程式如下: N2(g)+3H2(g)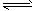 2NH3(g)
2NH3(g)
△H=-93.4kJ/mol
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。
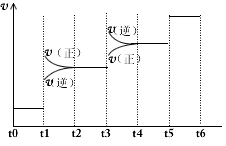
图t1时引起平衡移动的条件可能是_____________。其中表示平衡混合物中NH3含量最高的一段时间是
_______________。
(5)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2.某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料.已知该反应的阳极反应为:4OH-―4e-=O2↑+2H2O,则阴极反应式为__________________________.有人提出,可以设计反应2CO=2C+O2(△H>0、△S<0)来消除CO的污染.请你判断是否可行并说出理由_________________________________________.
参考答案:(1)保护臭氧层
(2)a;c?
(3)①0.225;② ;减小;③CD
;减小;③CD
(4)加压;t2~t3?
(5)2CO2+4e-+2H2O==2CO+4OH-;不可行,该反应是一个焓增、熵减的反应,任何情况下不能自发进行
本题解析:
本题难度:困难
2、填空题 碘缺乏症遍及全球,多发生于山区,南美的安第斯山区、欧洲的阿尔卑斯山区和亚洲的喜马拉雅山区是高发病地区。我国云南、河南等10余省的山区发病率也较高,据估计我国患者大约有1 000万人。为控制该病的发生,较为有效的方法是食用含碘食盐。我国政府以国家标准的方式规定在食盐 中添加碘酸钾(KIO3),据此回答下列问题。
(1)碘是合成下列哪种激素的主要原料之一(? )
A.胰岛素 B.甲状腺激素 C.生长激素 D.雄性激素
(2)长期生活在缺碘山区,又得不到碘盐的供应,易患(?)
A.甲状腺亢进 B.佝偻病 C.地方性甲状腺肿 D.糖尿病
(3)可用盐酸酸化的碘化钾和淀粉检验食盐中的碘酸钾。反应的化学方程式为___,氧化产物 与还原产物的物质的量之比为____,能观察到的明显现象是____。
(4)已知KIO3可用电解方法制得。原理是:以石墨为阳极,以不锈钢为阴极,在一定电流强度和温 度下电解KI溶液。总反应化学方程式为KI+ 3H2O KIO3+3H2↑,则两极反应式分别为阳极___,阴极____。
KIO3+3H2↑,则两极反应式分别为阳极___,阴极____。
(5)在某温度下,若以12 A的电流强度电解KI溶液10 min,理论上可得标准状况下氢气___L。
参考答案:(1) B
(2) C
(3) 5KI+ KIO3+6HCl=6KCl+ 3H2O+3I2 ;5:1 ;溶液变蓝色
(4)I-+3H2O -6e-=IO3-+6H+? ;6H+ +6e-=3H2↑
(5)0. 837
本题解析:
本题难度:一般
3、填空题 (1)氮的氢化物肼(N2H4)是航天火箭发射常用的燃料 ?
①发射火箭时肼(N2H4)为燃料,二氧化氮作氧化剂,两者反应生成氮气和气态水。已知4gN2H4(g)在上述反应中放出71kJ的热量,写出该反应的热化学方程式_________。 ?
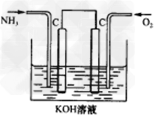
?②工业上可采用电化学的方法获得N2H2,装置如图,则通入氨气一极的电极反应式为_______________。?
③将标准状况下112?mL?CO2通入100?mL?0.1?mol/L的氨水中,所得溶液pH=10,则溶液中离子浓度以大到小的顺序___________。该溶液中:c(HCO3-)+c(CO32- )+c(H2CO3)=___________(忽略溶液体积的变化)。 ?
(2)T℃下,某2L容器内A、M、N三种物质参与的某一化学反应:
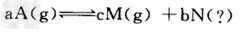 ?
?
①其物质的量随反应时间的变化的曲线如图,此反应0~5min反应物A的反应速率为__________;若达到平衡后移走1mol?A,再次达平衡后M小于0.75?mol,则该反应在T℃的化学平衡常数为___________。?
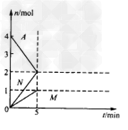
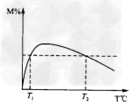
②若为了寻找该反应的最佳条件,在反应过程中持续不断地升高温度,所得的M的体积分数如下图,则温度T1和T2下化学平衡常数 K1___________K2(填“>”、“<”“=”)
参考答案:(1)①2N2H4(g)+2NO2(g)=3N2(g)+4H2O(g);△H=-1136KJ/mol
②2NH3-2e-+2OH-=N2H4+2H2O
③c(NH4+)>c(CO32-)>C(OH-)>c(HCO3-)>c(H+)?;?0.05mol/L?
(2)①0.2mol/(L·min);?0.5? ;②>
本题解析:
本题难度:一般
4、填空题 在25℃时,用石墨电极电解1.0L 2.5mol/LCuSO4溶液。5min后,在一个石墨电极上有3.2g Cu生成。试回答下列问题:
(1)________极发生氧化反应,电极反应式为__________________。
(2)有________mol电子发生转移,得到O2的体积(标准状况)是________mL ,溶液的pH是________。
(3)如用等质量的两块铜片代替石墨作电极,电解相同时间后两铜片的质量相差________g,电解液的
pH________(填“变小”、“变大”或“不变”)
参考答案:(1)阳;2H2O-4e-==4H++O2↑(或4OH--4e-==2H2O+O2↑)
(2)0.1;560;1
(3)6.4;不变
本题解析:
本题难度:一般
5、填空题 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。已知:
CH4(g)+ H2O(g)==== CO(g)+3H2(g) △H =206.2kJ·mol-1
CH4(g)+ CO2(g)==== 2CO(g)+2H2(g)△H =247.4kJ·mol-1
2H2S(g)====2H2(g)+S2(g) △H =169.8kJ·mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为_____________________。
(2)H2S热分解制氢时,常向反应器中通入一定比例空气,使部分H2S燃烧,其目的是__________________________;燃烧生成的SO2与H2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:
_____________________。
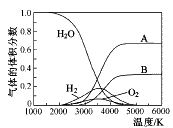
(3)H2O的热分解也可得到H2,高温下水分解体系中主要气体的体积分数与温度的关系如图所示。图中A、B表示的物质依次是______________。
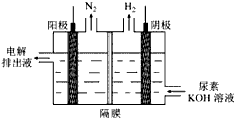
(4)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见下图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为__________________。
(5)Mg2Cu是一种储氢合金。350℃时,Mg2Cu与H2反应,生成MgCu2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077)。Mg2Cu与H2反应的化学方程式为______________________。
参考答案:(1)CH4(g)+2H2O(g)==CO2(g)+4H2(g) △H = 165.0 kJ·mol-1
(2)为H2S热分解反应提供热量;2H2S+SO2==2H2O+3S↓(或4H2S+2SO2==4H2O+3S↓)
(3)H、O(或氢原子、氧原子) (4)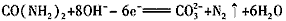
(5)
本题解析:
本题难度:一般