微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 现有如图所示的转化关系,图中各物质均为常见物质,转化中有部分物质已省略。
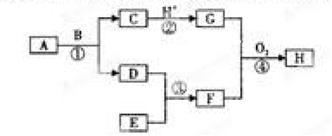
上述物质中C是一种黑色磁性固体,F是极易溶于水且水溶液呈碱性的气体,H是红褐色沉淀,A、D、E均为单质,请回答下列问题:
(1)写出下列物质的化学式:A: 、E
(2)写出④中生成H的非氧化还原反应的离子方程式:
(3)在120℃、1大气压下将168gA和90gB放入1L,密封烧瓶中发生反应①,经过10min达到平衡,平衡后D的质量为4g(固体体积忽略不计),则用D表示10min内的平均反应速率为 ,该温度下此反应的平衡常数K= ,B的转化率是 。
参考答案:(1)Fe(1分) N2(1分)
(2)Fe3++3NH3+H2O==Fe(OH)3↓+3NH4+(2分)
(3)V(H2)=0.2mol·L-1·min-1(2分) K=(2/3)4或2/3(3分) 40%(3分)
本题解析:由题意知,A为Fe,B为H2O,C为Fe3O4,D为H2,E为N2,F为NH3,H为Fe(OH)3。
(2)C为Fe3O4与H+反应后在G中即含有Fe3+又含有Fe2+,故生成H的非氧化还原反应只能是Fe3+生成Fe(OH)3。
(3)反应写出①:3Fe + 4H2O(g) = Fe3O4 + 4H2
开始 166g 90g
10min后 3mol 4g
转化 2mol 2mol
故V(H2)=" 2mol/1L/10min" = 0.2mol·L-1·min-1;
平衡常数K=c4(H2)/ c4(H2O) = (2/3)4;
B的转化率=2mol/5mol=40%。
考点:无机物的推断,化学反应速率、化学平衡常数、转化率的计算
本题难度:一般
2、填空题 某温度时,在2L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。

(1)体系中发生反应的化学方程式是___________________________
(2)列式计算该反应在0-3min时间内产物Z的平均反应速率:_______________
(3)该反应达到平衡时反应物X的转化率等于___________________________
(4)如果该反应是放热反应。改变实验条件(温度.压强.催化剂)得到Z随时间变化的曲线①.②.③(如图所示)则曲线①.②.③所改变的实验条件和判断理由是

① __________________________
② __________________________
③ __________________________
参考答案:(1)X+2Y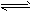 2Z
2Z
(2)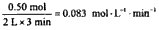
(3)45%
(4)①升高温度,该反应为放热反应 达到平衡的时间缩短,平衡时Z的浓度减小
②加入催化剂,达到平衡的时间缩短,平衡时Z的浓度减小
③增大压强,达到平衡的时间缩短,平衡时Z的浓度增大
本题解析:
本题难度:困难
3、简答题 (1)研究硫及其化合物性质有重要意义.
硫酸工业生产中涉及如下反应:2SO2(g)+O2(g)═2SO3(g).向2L的容器中充入2mol SO2、1mol O2,SO2的平衡转化率与温度的关系如图所示.T1温度时反应进行到状态D时,v(正)______v(逆)(填“>”、“<”或“=”).温度为T1时,反应的平衡常数K=______.(单位必须写),若在T3温度时,达平衡时测得反应放出的热量为Q1.此时再向容器中加入2mol SO2、1mol O2并使之重新达到平衡,测得又放出热量Q2.则下列说法正确的是______.(填字母编号)
a.容器的压强增大原来的两倍b.Q2一定等于Q1
c.新平衡时SO2的转化率一定大于80% d.T3时的平衡常数大于T1时的平衡常数
(2)已知:25℃时,Ksp[Mg(OH)2]=5.6×10-12,Ksp(MgF2)=7.4×10-11.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)______(填增大、减小或不变);在等浓度的KOH和KF混合溶液中加入稀MgCl2溶液,首先生成的沉淀是______(写化学式).
(3)Al2(SO4)3溶液显示酸性,其原因是______(写离子方程式),向某酸化的Al2(SO4)3溶液中加入NaHCO3固体,出现的现象是:有大量气体产生,同时有白色沉淀,试用平衡移动原理解释原因:______.
(4)加热蒸发下列溶液,能析出得到原溶质的是______.
a.KNO3溶液b.AlCl3溶液c.Al2(SO4)3溶液d.盐酸
(5)25℃时,pH为4的氯化铵溶液和pH为4盐酸溶液中,由水电离出的H+浓度之比为______.
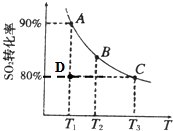
参考答案:(1)温度T1时,平衡点为A,D点二氧化硫转化率小于A,反应向正方向进行,V正>V逆,
转化的二氧化硫的物质的量:2mol×90%=1.8mol
2SO2(g)+O2(g) ═2SO3(g)
起始浓度 1mol/L 0.5mol/L 0
转化浓度 0.9mol/L 0.45mol/L 0.9mol/L
平衡浓度 0.1mol/L 0.05mol/L 0.9mol/L K=[SO3]2[SO2]2[O2]=1620L/mol,故答案为:1620L/mol;
T3时,若再向容器中加入2mol SO2、1mol O2,若平衡不移动压强变为原来的2倍,但是该反应前后气体系数不同,加入2mol SO2、1mol O2,相当增大压强平衡向正方向移动,故a错误;达平衡时测得反应放出的热量为Q1.此时再向容器中加入2mol SO2、1mol O2,相当于原容器加压,平衡向正反应方向移动,所以放出的热量增大,故Q2>Q1,故b错误;平衡向正反应方向移动,反应物的转化率增大,故c正确;正反应为放热反应,升高温度K减小,故d错误,故选c,
故答案为:>;1620L/mol;c;
(2)根据Mg(OH)2沉淀溶解平衡Mg(OH)2 (s)Mg2+(aq)+2OH- (aq),加入氯化铵,NH4+消耗氢氧根使平衡右移,镁离子浓度增大;故答案为:增大;
氢氧化镁与氟化镁,结构相同,Ksp[Mg(OH)2]=5.6×10-12,Ksp(MgF2)=7.4×10-11,二者氢氧化镁溶解度更小,先沉淀,故答案为:Mg(OH)2;
故答案为:增大;Mg(OH)2;所以溶液显酸性;
(3)Al2(SO4)3是强酸弱碱盐,铝离子水Al3++3H2O Al(OH)3+3H+所以溶液显酸性,加入碳酸氢钠后,碳酸氢根离子发生水HCO3-+H2O H2CO3+OH-,水解生成的氢氧根离子与铝离子水解生成的氢离子反应,双方相互促进,发生双水解,所以有大量气体产生,同时有白色沉淀,
故答案为:Al3++3H2O?Al(OH)3+3H+;铝离子和碳酸氢根离子发生双水解,相互促进,使水解平衡向正方向进行;
(4)a.硝酸钾溶液中不存在水解物质,蒸干水后得到硝酸钾固体,故a正确;
b.AlCl3水解生成氢氧化铝和氯化氢,加热氯化氢易挥发,促进水解平衡向右移动,所以整个该溶液得到的是氢氧化铝固体,故b错误;
c.Al2(SO4)3虽然水解但是生产的硫酸是难挥发性酸,蒸干溶液得到仍然是硫酸铝固体,故c正确;
d.盐酸是挥发性酸,加热促进氯化氢的挥发,蒸干后得不到原溶质,故d错误;
故选ac;
(5)pH=4的氯化铵溶液中,水电离的氢离子浓度:C(H+)=10-4mol/L,pH=4的盐酸溶液中,水电离的氢离子的浓度:C(H+)′=10-10mol/L,C(H+):C(H+)′=106(或 106:1),故答案为:106(或 106:1).
本题解析:
本题难度:一般
4、选择题 在2X(g)?2Y(g)+Z(g)△H<0?的可逆反应体系中,在不同温度(T1>T2)下,生成物Z在反应混合物中的百分含量与反应时间(t)的关系有以下图示,其中正确的是( )
A.

B.

C.
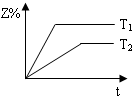
D.

参考答案:B
本题解析:
本题难度:简单
5、简答题 甲醇是一种可再生能源,具有广泛的开发和应用前景,因此甲醇被称为21世纪的新型燃料.工业上用CO生产燃料甲醇,一定条件下发生反应:CO(g)+2H2(g)?CH3OH(g).图l表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化图.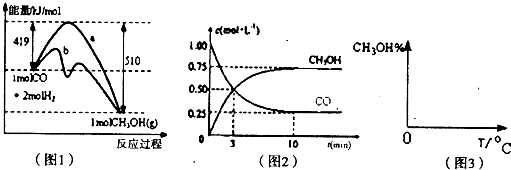
请回答下列问题:
(1)在“图1”中,曲线______(填“a”或“b”)表示使用了催化剂;该反应属于______(填“吸热”或“放热”)反应.
(2)根据“图2”判断,下列说法正确的是______
a.起始充入的CO为1mol
b.增加CO浓度,可使H2的转化率增大
c.容器中压强恒定时,反应已达平衡状态
d.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会增大
(3)从反应开始到建立平衡,v(H2)=______;该温度下CO(g)+2H2(g)?CH3OH(g)的化学平衡常数为______.若保持其它条件不变,将反应体系升温,则该反应的化学平衡常数将______(填“增大”、“减小”或“不变”).
(4)请在“图3”中画出平衡时甲醇蒸气百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1>P2).
参考答案:(1)加入催化剂,可降低反应的活化能,由图象可知b活化能较低,应加入催化剂,反应物的总能量大于生成物的总能量,则反应为放热反应,
故答案为:b;放热;
(2)A.CO的起始浓度为1moL/L,体积为2L,则起始充入的CO为2mol,故a错误;
B.增加CO浓度,平衡向正方向移动,H2的转化率增大,故b正确;
C.由于反应前后气体的体积不等,则容器中压强恒定时,反应已达到平衡状态,故c正确;
D.保持温度和密闭容器容积不变,再充入1mol CO和2mol H2,相当于在原来的基础上缩小体积,压强增大,平衡向正反应方向移动,则平衡时n(CH3OH)n(CO)会增大,故d正确.
故答案为:bcd;
(3)从反应开始到建立平衡,v(CO)=1mol/L-0.25mol/L10min=0.075moL/(L?min),
则v(H2)=2v(CO)=0.15moL/(L?min),
平衡时:c(CO)=0.25mol/L,c(CH3OH)=0.75mol/L,
则消耗n(CO)=0.75mol/L×2L=1.5mol,消耗的n(H2)=3mol,
平衡时c(H2)=4mol-3mol2L=0.5mol/L,
k=0.750.25×0.52=12,
故答案为:0.15moL/(L?min);12;
(4)增大压强,平衡向正反应方向移动,则甲醇的百分含量增大,温度升高,平衡向逆反应方向移动,甲醇的百分含量降低,则图象可为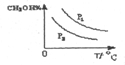 ,
,
故答案为: .
.
本题解析:
本题难度:一般