| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点整理《与量有关的离子方程式的书写》试题预测(2017年最新版)(十)
参考答案:D 本题解析:A项:违法客观事实,熔融态不会有水,故错;B项:违法客观事实,硝酸有很强的氧化性,与金属反应不生成氢气,故错;C项:电荷不守恒,故错。故选D。 本题难度:简单 4、填空题 现有一种溶液,其中可能含有Mg2+、Al3+、Fe2+、Cu2+、NH4+.当加入一种淡黄色固体并加热溶解时,有刺激性气味的气体放出和白色沉淀生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标)的关系如图所示.试回答下列问题:
(4)图中b点的气体组成成分是(填化学式)______,其物质的量之比是______. 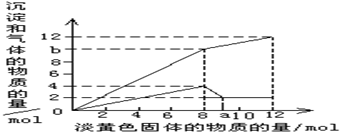 参考答案:(1)淡黄色粉末是过氧化钠,溶液时无色透明,排除铁离子和铜离子,首先加入过氧化钠与水反应,2Na2O2+2H2O=4NaOH+O2↑,当加入过量的过氧化钠时,生成白色沉淀,推断一定有Mg2+,通过图象知,在加入过量的过氧化钠的过程中,沉淀部分溶解,推断一定含有Al3+,氢氧化镁不溶于强碱,氢氧化铝是两性氢氧化物,可以溶于强碱,最终的白色沉淀的成分是氢氧化镁,故答案为:Mg(OH)2;氢氧化镁不溶于强碱,氢氧化铝是两性氢氧化物,可以溶于强碱; 本题解析: 本题难度:简单 5、选择题 下列离子方程式书写正确的是? 参考答案:D 本题解析:碘离子具有还原性,铁离子具有氧化性,A中发生氧化还原反应,生成物是碘化亚铁、单质碘和水;醋酸是弱酸,应该用化学式表示;次氯酸也是弱酸,应该用化学式表示,因此正确的答案选D。 本题难度:简单 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学试题《分散系》高频考点.. | |