微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 有A、B、C、D四种金属。将A与B用导线连接起来,浸入电解质溶液中,B不易腐蚀;将A、D分别投入等浓度盐酸中,D比A反应剧烈;将铜浸入B的盐溶液里,无明显变化;如果把铜浸入C的盐溶液里,有金属C析出。据此,判断它们的活动性由强到弱的顺序是
A.D>C>A>B?
B.D>A>B>C?
C.D>B>A>C?
D.B>A>D>C
参考答案:B
本题解析:考查金属性强弱比较。比较元素金属性强弱的依据
1.在一定条件下金属单质与水反应的难易程度和剧烈程度。一般情况下,与水反应越容易、越剧烈,其金属性越强。
2.常温下与同浓度酸反应的难易程度和剧烈程度。一般情况下,与酸反应越容易、越剧烈,其金属性越强。
3.依据最高价氧化物的水化物碱性的强弱。碱性越强,其元素的金属性越强
4.依据金属单质与盐溶液之间的置换反应。一般是活泼金属置换不活泼金属。但是ⅠA族和ⅡA族的金属在与盐溶液反应时,通常是先与水反应生成对应的强碱和氢气,然后强碱再可能与盐发生复分解反应。
5.依据金属活动性顺序表(极少数例外)。
6.依据元素周期表。同周期中,从左向右,随着核电荷数的增加,金属性逐渐减弱;同主族中,由上而下,随着核电荷数的增加,金属性逐渐增强。
7.依据原电池中的电极名称。做负极材料的金属性强于做正极材料的金属性。
8.依据电解池中阳离子的放电(得电子,氧化性)顺序。优先放电的阳离子,其元素的金属性弱。
据此可知,选项B正确,答案选B。
本题难度:困难
2、填空题 (1)鉴别Fe(OH)3胶体和FeCl3溶液的方法是
(2)除去KNO3溶液中的I2杂质,主要操作步骤是:加CCl4后,振荡,静置, 。水溶液最终从分液漏斗的 分离出来
(3)黑火药是中国的“四大发明”之一。黑火药在发生爆炸时,发生如下的反应:
2KNO3+C+S=K2S+2NO2↑+CO2↑。其中被氧化的元素是 ,氧化剂是 ,生成1molCO2时转移的电子数目为(NA表示阿伏伽德罗常数的值)
参考答案:(1)丁达尔效应 (2)分液,上口 (3)C; KNO3和S; 4NA
本题解析:(1)溶液和胶体的鉴别:丁达尔效应;(2)除去KNO3溶液中的I2杂质,萃取和分液,分液时注意,下层液体从下口放出,上层液体从上口倒出;(3)应用氧化还原反应基本概念进行判断,注意标清变价元素的化合价。
考点:考查化学实验---物质的分离提纯及氧化还原反应基本概念。
本题难度:一般
3、选择题 下列过程需加入还原剂才能实现的是
A.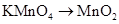
B.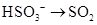
C.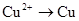
D.