|
高中化学知识点总结《电解池原理》高频考点巩固(2017年模拟版)(八)
2017-08-22 14:14:02
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 工业上生产Na、Ca、Mg都用电解其熔融的氯化物,但钾却不能用电解熔融KCl的方法制得,因金属钾易溶于熔融态的KCl中而有危险,难获得钾,且降低电流效率。现生产钾是用属钠和熔化的KCl在一定的条件下反应制取:
 ? KCl + Na?NaCl + K + Q (Q<0) ? KCl + Na?NaCl + K + Q (Q<0)
有关数据如下表:
?
| 熔点℃
| 沸点℃
| 密度(g/cm3)
| Na
| 97.8
| 882.9
| 0.97
| K
| 63.7
| 774
| 0.86
| NaCl
| 801
| 1413
| 2.165
| KCl
| 770
| 1500(升华)
| 1.984
|
(1) 工业上制取金属钾的化学原理是?,在常压下金属钾转为气态从反应混合物中分离的最低温度约为?,而反应的最高温度应低于?。
(2)在制取金属钾的过程中,为了提高原料的转化率可采取的措施是?。
(3)生产中常向反应物中通入一种气体,并将从反应器中导出的气体进行冷却得到金属钾,?
且将该气体可循环利用,该气体是________。
a.干燥的空气? b.氮气? c.二氧化碳? d.稀有气体
(4)常压下,当反应温度升高到900℃时,该反应的平衡常数可表示为K=?。
参考答案:(1) 化学平衡移动原理(勒夏特列原理/钾蒸汽逸出使生成物浓度减小,平衡向正反应方向移动,可不断得到金属钾) 774℃? 882.9℃?(每空1分,共3分)?
(2) 适当的升高温度、降低压强或移去钾蒸气 (2分)?
(3)d (1分)?
(4)?c(K)/c(Na) (1分)
本题解析:略
本题难度:一般
2、选择题 用石墨作电极,电解lmol/L下列物质的溶液,溶液的PH保持不变的是
A.HCl
B.NaOH
C.Na2SO4
D.NaCl
|
参考答案:C
本题解析:根据溶液中离子的放电顺序判断溶液中氢离子浓度是否变化,从而确定溶液pH值是否变化,A、电解盐酸,溶液中氢离子、氯离子放电,所以溶液中氢离子浓度逐渐减小,pH值逐渐变大,A错误;B、电解氢氧化钠,溶液中氢离子、氢氧根离子放电,相当于电解水,导致溶液中氢氧化钠的浓度增大,溶液的pH值增大,B错误;C、电解硫酸钠溶液,溶液中氢离子、氢氧根离子放电,相当于电解水,导致溶液中硫酸钠的浓度增大,但溶液中氢离子和氢氧根离子的浓度不变,所以溶液的pH值保持不变,C正确;D、电解氯化钠,溶液中氢离子和氯离子放电,所以溶液中氢离子浓度逐渐减小,pH值逐渐变大,D错误;选C。
考点:考查电解及PH。
本题难度:一般
3、填空题 23.(12分)能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上合成甲醇的反应原理为:CO(g) + 2H2(g)  CH3OH(g) ΔH; CH3OH(g) ΔH;
下表所列数据是该反应在不同温度下的化学平衡常数(K)。
温度
| 250℃
| 300℃
| 350℃
| K
| 2.041
| 0.270
| 0.012
|
①根据表中数据可判断ΔH 0 (填“>”、“=”或“<”)。
②在300℃时,将2 mol CO、3 mol H2和2 mol CH3OH充入容积为1L的密闭容器中,此时反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
(2)以甲醇、氧气为原料,KOH溶液作为电解质构成燃料电池总反应为:2CH3OH+3O2+4OH-=2CO32-+6H2O,则负极的电极反应式为: ,随着反应的不断进行溶液的pH (填“增大”“减小”或“不变”)。
(3)如果以该燃料电池为电源,石墨作两极电解饱和食盐水,则该电解过程中阳极的电极反应式为: ;如果电解一段时间后NaCl溶液的体积为1L,溶液的pH为12(25℃下测定),则理论上消耗氧气的体积为 mL(标况下)。
参考答案:(1)①< ②向正反应方向进行
(2) CH3OH+ 8OH—-6e—= CO32—+6H2O;减小
(3) 2Cl—-2e—=Cl2↑;56
本题解析:根据所给表格可知随着温度的升高,K逐渐减小,得到该反应为放热反应,因而ΔH<0;在300℃时,将2 mol CO、3 mol H2和2 mol CH3OH充入容积为1L的密闭容器中,CO有剩余,反应物的浓度增大,平衡向正反应方向移动;将总反应分解得负极的电极反应CH3OH+ 8OH—-6e—= CO32—+6H2O;随着反应的进行,H+逐渐产生,所以pH减小;电解饱和食盐水,阳极生成了氯气,电极反应:2Cl—-2e—=Cl2↑;pH=12说明c(OH-)=0.01mol/L;根据电荷守恒,n(O2)=0.0025mol,V=0.056L=56ml
考点:化学平衡及相关计算
点评:本题做题的关键是掌握平衡移动的原理,将燃料电池的知识与平衡移动相联系,综合性较强。
本题难度:困难
4、简答题 (15分)目前,全世界的镍消费量仅次于铜、铝、铅、锌,居有色金属第五位。镍行业发展蕴藏着巨大的潜力。镍化合物中的三氧化二镍是一种重要的电子元件材料和二次电池材料。工业上可利用含镍合金废料(除镍外,还含有Fe、Cu、Ca、Mg、C等杂质)制取草酸镍,然后高温煅烧草酸镍来制取三氧化二镍。
已知:①草酸的钙、镁、镍盐均难溶于水,且溶解度:NiC2O4> NiC2O4·H2O> NiC2O4·2H2O
②常温下,Ksp[(Fe(OH))3]=4.0×10-38,lg5=0.7
根据下列工艺流程图回答问题:

(1)加6%的H2O2时,温度不能太高,其目的是 。若H2O2在一开始酸溶时便与盐酸一起加入,会造成酸溶过滤后的滤液中增加一种金属离子,用离子方程式表示这一情况 。
(2)流程中有一步是调pH,使Fe3+转化为Fe(OH)3沉淀,常温下当溶液中c (Fe3+)=0.5×10-5mol/L时,溶液的pH= 。
(3)流程中加入NH4F的目的是 。
(4)将最后所得的草酸镍晶体在空气中强热到400℃,可生成三氧化二镍和无毒气体,写出该反应的化学方程式 。
(5)工业上还可用电解法制取三氧化二镍,用NaOH溶液调节NiCl2溶液的pH至7.5,再加入适量Na2SO4进行电解,电解产生的Cl2其80%的可将二价镍氧化为三价镍。写出Cl2氧化Ni(OH)2生成三氧化二镍的离子方程式 ;将amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是 。
(6)近年来镍氢电池发展很快,它可由NiO(OH)跟LaNi5H6(LaNi5H6中各元素化合价均可看作是零)组成:6NiO(OH)+LaNi5H6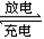 LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。 LaNi5+6Ni(OH)2。该电池放电时,负极反应是 。
参考答案:(15分)(1)减少过氧化氢的分解(1分) Cu+ H2O2+2H+= Cu2++ 2H2O(2分)
(2)3.3(2分)
(3)除去Ca2+、Mg2+(2分)
(4)4(NiC2O4·2H2O)+3O2  2Ni2O3+8CO2+8H2O(2分) 2Ni2O3+8CO2+8H2O(2分)
(5)Cl2+2Ni(OH)2+2OH-=Ni2O3 +2Cl-+3H2O(2分) 1.25a mol(2分)
(6)LaNi5H6+6OH--6e-=LaNi5+6 H2O(2分)
本题解析:(1)过氧化氢受热易分解,所以温度不能过高的原因是减少过氧化氢的分解;Fe、Ca、Mg均与盐酸直接反应,过氧化氢的加入造成酸溶过滤后的滤液中增加一种金属离子,则该金属离子只能是铜离子,所以反应的离子方程式为Cu+ H2O2+2H+= Cu2++ 2H2O;
(2)Ksp[(Fe(OH))3]=4.0×10-38=c(Fe3+)c(OH-)3,c(OH-)3=8×10-33mol/L,c(OH-)=2×10-11mol/L,所以c(H+)=5×10-4,lg5=0.7,所以pH=3.3;
(3)加入NH4F后的操作是过滤,说明该过程有沉淀产生,所以加入NH4F的目的是除去Ca2+、Mg2+;
(4)根据题目可知无毒气体是二氧化碳,
所以化学方程式为4(NiC2O4·2H2O)+3O2 2Ni2O3+8CO2+8H2O; 2Ni2O3+8CO2+8H2O;
(5)根据氧化还原反应理论,Cl2氧化Ni(OH)2生成三氧化二镍,自身被还原为氯离子,化学方程式为Cl2+2Ni(OH)2+2OH-=Ni2O3 +2Cl-+3H2O;amol二价镍全部转化为三价镍时,需要氯气0.5amol,氯气的利用率是80%,则电解过程中的氯气是0.5amol/0.8,每生成1mol氯气转移2mol电子,所以外电路中通过电子的物质的量是0.5amol/0.8×2=1.25amol;
(6)NiO(OH)中Ni的化合价是+3价,Ni(OH)2中Ni是+2价,化合价降低,发生还原反应,所以放电时负极应发生氧化反应,LaNi5H6为负极反应物质,LaNi5H6中各元素化合价均可看作是零,所以化合价升高的只能是H元素,电极反应式为LaNi5H6+6OH--6e-=LaNi5+6 H2O。
考点:考查溶度积的计算,流程的分析,化学方程式的判断与书写,氧化还原反应的计算,电化学理论的应用
本题难度:一般
5、填空题 (9分)目前世界上比较先进的电解制碱技术是离子交换膜法。
(1)电解前,如果粗盐中SO42ˉ含量较高,必须添加试剂除去SO42ˉ,则按添加试剂顺序,依次发生反应的离子方程式为?。
(2)补齐下列电解饱和食盐水制烧碱的离子方程式:
______________________  __________________________________ __________________________________
(反应物)?(阴极产物)?(阳极产物)
(3)在电解制得的NaOH中往往还含有一定量的NaCl,因此必需进行脱盐工序,脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过?、冷却、??(填写操作名称)除去NaCl。
(4)已知NaCl在60℃的溶解度为37.1 g,现电解60℃精制饱和食盐水1371 g。经分析,电解后溶液密度为1.37 g·cm-3,其中含有20gNaCl,则电解后NaOH的物质的量浓度为__________mo1·L-1(保留小数点后1位)。
参考答案:(1)Ba2+ + SO42ˉ = BaSO4↓? CO32ˉ+ Ba2+ =BaCO3↓? 2H+ + CO32ˉ= H2O+CO2↑(3分,顺序颠倒没分)
(2)2Clˉ+2H2O  ?H2↑ + 2OHˉ? +? Cl2↑?(2分) ?H2↑ + 2OHˉ? +? Cl2↑?(2分)
阴极产物?阳极产物?
(3)蒸发过滤?(每个1分,共2分)?(4)7.1(2分)
本题解析:(1)除去SO42-需要氯化钡溶液,而过量的氯化钡又需要碳酸钠溶液,最后加入盐酸除去过量的碳酸钠,因此有关反应的方程式是Ba2+ + SO42ˉ = BaSO4↓、CO32ˉ+ Ba2+ =BaCO3↓ 、2H+ + CO32ˉ= H2O+CO2↑。
(2)惰性电极调节食盐水时,阳极是氯离子放电生成氯气。阴极是氢离子放电生成氢气,同时破坏阴极周围水的电离平衡,因此氢氧化钠在阴极生成,所以反应的方程式是2Clˉ+2H2O  ?H2↑ + 2OHˉ? +? Cl2↑? ?H2↑ + 2OHˉ? +? Cl2↑?
阴极产物?阳极产物?
(3)由于氢氧化钠和氯化钠的溶解度随温度的变化相差较大,所以可以通过蒸发、冷却和过滤的方法除去氯化钠。
(4)电解前氯化钠的氯化钠的质量是1371g×37.1/137.1=371g,而电解后氯化钠是20g,所以电解的氯化钠是351g,物质的量是351g÷58.5g/m=6mol。因此根据反应的方程式可知,生成氢氧化钠是6mol,氢气和氯气都是3mol,所以反应后的溶液质量是1371g-2g/mol%3mol-71g/mol×3mol=1152g,则溶液的体积是1152g÷1.37g/ml=840.9ml,所以氢氧化钠的浓度是6mol÷0.841L=7.1mol/L。
本题难度:一般
|