微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 (9分)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
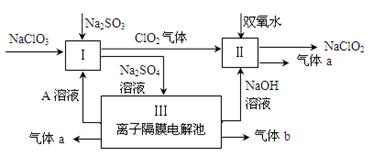
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是 、 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该制备反应的化学方程式 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 。(填“相同”,“不同”或“无法判断”)
参考答案:(9分)
(1) Na2SO3 H2O (各1分)
(2) 2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O(2分)
(3) H2SO4 阳(各1分)
(4)5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑ + 2H2O(2分)
(5) 相同(1分)
本题解析:氯酸钠和亚硫酸钠与溶液A发生氧化还原反应生成硫酸钠和ClO2气体,则该反应中S元素的化合价升高,所以亚硫酸钠作还原剂;生成的硫酸钠进入电解池,则实质被电解的是水,所以水是还原剂也是氧化剂;过氧化氢、ClO2气体、NaOH三种物质反应生成NaClO2和气体a,因为Cl元素的化合价降低,所以过氧化氢中O元素的化合价升高,则气体a为氧气;则气体b为氢气。
(1)根据以上分析,Ⅰ、Ⅲ中发生反应的还原剂分别是Na2SO3、 H2O;
(2)Ⅱ中反应是过氧化氢、ClO2气体、NaOH三种物质反应生成NaClO2和氧气,根据元素守恒,则产物中有水生成,所以反应的离子方程式是2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O;
(3)因为III是离子隔膜电解池,则阳极是氢氧根离子放电,导致阳极的氢离子浓度增大,硫酸根离子通过隔膜进入阳极区,所以产生氧气的一极同时产生硫酸,则溶液A的化学式为H2SO4,在阳极区产生;
(4)用亚氯酸钠和稀盐酸为原料制备ClO2,Cl元素的化合价有-1、+3、+4价,根据氧化还原反应规律,则亚氯酸钠中的Cl元素的化合价升高到+4价,同时降低到-1价,所以产物中有水、氯化钠生成,则化学方程式为5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑ + 2H2O;
(5)NaClO2变质可分解为NaClO3和NaCl,化学方程式为3 NaClO2=2NaClO3+NaCl,等质量的变质前后的NaClO2试样均配成溶液时,变质后的NaClO3和NaCl氧化亚铁离子时,实质是等量的NaClO2氧化亚铁离子,都是+3价Cl元素被还原为氯离子,转移电子的数目相同,所以消耗Fe2+的物质的量相同。
考点:考查制取亚氯酸钠的工业流程的分析,氧化还原反应的分析
本题难度:困难
2、填空题 (6分)下图表示一个精炼粗铜的电解池,电解液a选用CuSO4溶液,X、Y是两块电极板,通过导线与直流电源相连
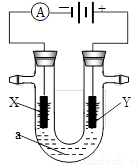
请回答以下问题
(1)Y电极的材料是 ,
(2)电极反应式是 ,
(3)X电极的现象是 。
参考答案:34.(1)粗铜 (2)Cu-2e-=Cu2+ (3)X电极上有红色的铜析出
本题解析:精炼粗铜时,粗铜做阳极,发生的主要反应为Cu-2e-=Cu2+,精铜做阴极,发生的电极反应为:Cu2++2e-=Cu,所以答案为:(1)粗铜 (2)Cu-2e-=Cu2+(3)X电极上有红色的铜析出。
考点:考查铜的电解精炼。
本题难度:一般
3、选择题 如图所示a、b 都是惰性电极,通电—段时间后,a极附近溶液显红色。下列说法中正确的是(? )。
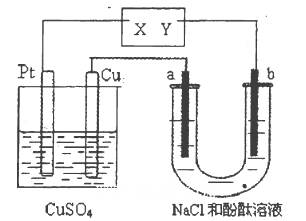 ?
?
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的浓度逐渐减小
D.CuSO4溶液的pH减小
参考答案:B
本题解析:该装置为电解装置,a极显红色,说明a极氢氧根离子浓度增大,氢离子浓度减小,所以a极氢离子放电,则a极为阴极,b极为阳极,Y为正极X为负极,A错误;B正确;因此铂极为阴极,铜离子放电成为单质铜,铜极为阳极,铜放电成为铜离子进入溶液,所以CuSO4溶液的浓度基本不变,pH基本不变,C、D错误,答案选B。
本题难度:简单
4、选择题 有关阳离子交换膜电解饱和食盐水的(装置如图)说法正确的是
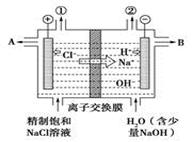
A.转移电子0.8 mol时产生氢气8.96 L
B.从出口B处导出的是氢氧化钠与氯化钠的混合溶液
C.装置中出口①处的气体能使湿润的淀粉碘化钾试纸变蓝
D.装置中的阳离子交换膜防止产生的氯气与氢氧化钠溶液反应
参考答案:B
本题解析:A、转移电子0.8 mol时产生氢气的量为0.8÷2×22.4="8.96" L(标准状况下),该题没有指明条件,错误;B、交换膜只能通过阳离子,氯离子不能通过,故出口B导出的是氢氧化钠溶液,错误;C、阳极氯离子失去电子,生成氯气,使湿润的淀粉碘化钾试纸变蓝,正确;D、电解时阳极产生的氯气与阴极产生的氢氧化钠通过交换膜隔离,防止反应,正确。
本题难度:简单
5、填空题 (10分)最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应如下:2CH3CHO+H2O CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示。
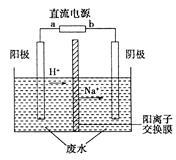
(1)若以锌锰碱性电池为直流电源,该电池总反应式为:Zn+2MnO2+2H2O===2MnO(OH)+Zn(OH)2。该电池的a电极的电极反应式为:_____________________________________________。
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。电极反应式如下:
阳极:①4OH--4e-===O2↑+2H2O。
②_______________________________________________。
阴极:①__________________________________________。
②CH3CHO+2e-+2H2O===CH3CH2OH+2OH-。
(3)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同。此时刻下列关于阳极区溶液中各微粒浓度关系的说法正确的是 (填序号)。
a.c(Na+)=2c(CH3COOH)+2c(CH3COO-)
b.c(Na+)+c(H+)=c(SO42-)+c(CH3COO-)+c(OH-)
c.c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-)
(4)已知:乙醛、乙醇的沸点分别为20.8 ℃、78.4 ℃。从电解后阴极区的溶液中分离出乙醇粗品的方法是 。
参考答案: (1) 2MnO2+2H2O+2e-=2MnO(OH)+2OH-。(2分)
(2)②CH3CHO-2e-+H2O=CH3COOH+2H+(2分)
①4H++4e-=2H2↑或2H++2e-=H2↑或4H2O+4e-=2H2↑+4OH-(2分)
(3)ac(2分) (5)分馏或蒸馏 (2分)
本题解析:(1)a电极与电解池的阳极相连,这说明a是正极。根据电池总反应式Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2可正极是二氧化锰得到电子,则该电池的a电极的电极反应式为2MnO2+2H2O+2e-=2MnO(OH)+2OH-。
(2)电解池中阳极失去电子,除了氢氧根放电外,乙醛失去电子转化为乙酸,反应的电极反应式外CH3CHO-2e-+H2O=CH3COOH+2H+;阴极得到电子,除了乙醛得到电子转化为乙醇以外,溶液中的氢离子也得到电子转化为氢气,电极反应式为2H++2e-=H2↑。
(3)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同。此时刻下列关于阳极区溶液中各微粒浓度关系的说法正确的是 (填序号)。
a.根据物料守恒可知c(Na+)=2c(CH3COOH)+2c(CH3COO-),a正确;b.根据电荷守恒c(Na+)+c(H+)=2c(SO42-)+c(CH3COO-)+c(OH-)可知c(Na+)+c(H+)=c(SO42-)+c(CH3COO-)+c(OH-)是错误的,b不正确;c.醋酸是一元弱酸,电离常数小,则溶液中c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-),c正确,答案选ac。
(4)已知:乙醛、乙醇的沸点分别为20.8 ℃、78.4 ℃,由于二者互溶,所以从电解后阴极区的溶液中分离出乙醇粗品的方法是蒸馏。
考点:考查电化学原理的应用、溶液中离子浓度比较以及物质的分离与提纯
本题难度:困难