微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 如何实现化石燃料的综合利用,减少化石燃料燃烧所造成的环境污染,是人类面临的重大挑战。下列关于化石燃料的说法不正确的是(?)
A.天然气除可用作清洁能源外,也可用于合成氨和生产甲醇等
B.煤的气化是指将固态煤粉碎成气态煤,以使煤燃烧时能与氧气充分接触而完全燃烧
C.石油分馏得到的汽油和石油催化裂化得到的汽油的成分和化学性质不相同
D.化石燃料也是重要的化工原料,乙烯和苯就是分别来自于石油和煤的基本化工原料
参考答案:B
本题解析:煤的气化是指将煤转化为可燃性气体的过程,是化学变化,选项C不正确,其余都是正确的,答案选B。
本题难度:简单
2、计算题 (1)25℃时, 0.05mol/LH2SO4溶液的PH=________;0.05mol/LBa(OH)2溶液PH=?;
(2)已知100℃时,KW=1×10-12在该温度下,将100ml0.001 mol/L的NaOH溶液加水稀释至1L,则该溶液的PH=?。
参考答案:(1)? 1? 13? (2)? 8
本题解析:(1)0.05mol/LH2SO4溶液中氢离子浓度为0.1mol/L,pH=1;25℃时0.05mol/LBa(OH)2溶液中氢氧根离子浓度为0.1mol/L,氢离子浓度为10-13mol/L,pH=13。
(2)100℃时,0.001 mol/L的NaOH溶液中氢氧根离子浓度为0.001mol/L,稀释到1L,氢氧根离子浓度为0.0001mol/L,氢离子浓度为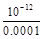 ?mol/L =10-8mol/L,pH=8。
?mol/L =10-8mol/L,pH=8。
点评:计算碱溶液pH时利用c(H+)= 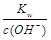 ,再求pH。
,再求pH。
本题难度:一般
3、选择题 下列说法正确的是? (? )
A.pH值为7的溶液一定呈中性
B.金属材料电镀时,通常以待镀金属制品为阳极,以镀层金属为阴极。
C.增大反应物浓度,可增大单位体积活化分子的数目,从而使反应速率增大
D.pH=3的盐酸和pH=11的氨水溶液,溶质的浓度和导电能力均相同
参考答案:C
本题解析:A不正确,只有溶液中氢离子浓度和OH-浓度相等,溶于才能显中性。电镀时,待镀金属作阴极,镀层金属作阳极,B不正确。D中氨水是弱碱,但在pH=11的氨水中,溶液中离子的浓度和pH=3的盐酸中相同,所以导电能力相同,答案选C。
本题难度:简单
4、选择题 常温下,水的离子积为Kw,下列说法正确的是( )
A.在pH=11的溶液中,水电离出的c(OH-)一定等于10-3 mol/L
B.将pH=1的酸和pH=13的碱溶液等体积混合后,溶液的pH一定等于7
C.将物质的量浓度和体积都相同的一元酸HA与一元碱BOH混合后,溶液呈中性,则反应后溶液中c(H+)=
D.若强酸、强碱中和后溶液的pH=7,则中和之前酸、碱的pH之和一定等于14
参考答案:C
本题解析:A项,如pH=11 NaOH溶液,水电离出c(OH-)=10-11mol·L-1,B项若是强酸和强碱溶液反应时,pH一定等于7,其它情况不一定。D项必须是等体积混合才符合。故选C。
本题难度:一般
5、选择题 常温下,向l00mL0.01mol HA溶液中逐滴加入0.02mol
HA溶液中逐滴加入0.02mol MOH溶液,如图所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是:
MOH溶液,如图所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中不正确的是:
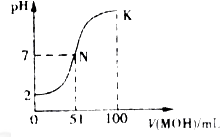
A.HA为一元强酸
B.MOH为一元弱碱
C.N点水的电离程度小于K点水的电离程度
D.若K点对应的溶液的PH=10,则有c(MOH)+ c(OH-)- c(H+)=0.005mol/L
参考答案:C
本题解析:由图像分析知加入碱的体积为51mL时溶液呈中性,说明二者不都是强电解质,若碱为强碱则加入碱50mL时恰好完全反应,此时为强碱弱酸盐,溶液应呈碱性,与图像不符,所以酸应为强酸,碱为弱碱。A、B正确;C、N点时,溶液呈中性,氢离子浓度等于氢氧根离子浓度=1×10-7mol/L,而K点时碱过量,抑制水的电离,所以N点水的电离程度大于K点水的电离程度,错误;D、在K点时加入碱的体积为100mL,此时溶液是MOH与MA等浓度的混合液且浓度都为0.005mol/L,根据物料守恒得c(MOH)+c(M+)="0.01" mol/L,根据电荷守恒得c(M+)+c(H+)=c(A-)+c(OH-),二式结合得
c(MOH)+ c(OH-)- c(H+)="0.01-" c(A-)=0.01-0.005=0.005mol/L,正确,答案选C。
本题难度:一般