| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《有关氧化还原反应的计算》高频试题预测(2017年最新版)(十)
依据溶液颜色的变化回答下列问题: (1)加入以上药品的顺序是_________________________________________________。 (2)写出①→②的离子反应方程式,若为氧化还原反应,请标明电子转移的方向和总数:_______________________________________________________________________。 (3)写出③→④的化学反应方程式:___________________________________________。 参考答案:(1)A、D、B、C 本题解析:溶液显棕黄色,说明溶液中有I2生成,氯水和KI溶液反应生成I2,而氯水显浅黄绿色,故①为KI溶液,②为氯水,溶液显蓝色是淀粉遇I2形成的,故③为淀粉溶液;又由于I2+2NaOH=NaI+NaIO+H2O,加入NaOH溶液后I2逐渐消失,蓝色将逐渐褪为无色,故④为NaOH溶液。 本题难度:一般 2、选择题 关于氧化还原反应CuO+H2 参考答案:B 本题解析:反中铜的化合价由+2价降至0价,得电子,被还原,氧化铜为氧化剂;氢元素化合价由0价升至+1价,失电子,被还原,氢气为还原剂。答案为B 本题难度:简单 3、填空题 (7分)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl |
 + OH
+ OH ————
———— 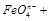


参考答案:(1)Ca(ClO)2 (1分)
(2)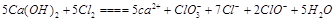 (2分)
(2分)
(3)5 (1分) (4)D (1分) (5)2, (5-n), 2n, (5-n) (n+3) (2分)
本题解析:(1)Ca(ClO)2;t1时间,Cl2只有失去电子生成了ClO-
(2)  根据得失电子守恒进行配平,最后ClO-与ClO3-的比例符合2比1。生成物根据元素守恒判断,氯气的价态即能升高到+1价和+3价,还有降低到-1价,所以生成了Cl-。
根据得失电子守恒进行配平,最后ClO-与ClO3-的比例符合2比1。生成物根据元素守恒判断,氯气的价态即能升高到+1价和+3价,还有降低到-1价,所以生成了Cl-。
(3)根据方程式计算,有图像可知ClO-为2mol ,最后氯气过量,所以Ca(OH)2的物质的量是5mol。
(4)NaClO2中氯的价态是+3价,发生歧化反应,即升高价态生成 NaClO3又降低价态生成NaCl。
(5)根据得失电子守恒来配平,首先标出生成物 FeO4n-中Fe的价态为8-n,所以Fe变化的价态为8-n-3,即5-n。反应物中氯的价态为+1价,生成的氯为-1价,所以变化的价态为2,取最小公倍数2(5-n),所以反应物种氢氧化铁前面配2,氯气前面配(5-n),ClO-前面配(5-n)。最后根据O元素守恒,H元素守恒,OH 前面配2n,
前面配2n, 前面配n+3。
前面配n+3。
考点:氧化还原反应、离子反应方程式的书写。
点评:本题考查比较综合,难点在于离子反应方程式的书写,以及利用氧化还原反应中得失电子守恒的原理。
本题难度:困难
4、选择题 溴化碘的化学式为IBr,它的化学性质活泼,能与大多数金属反应,也能跟某些非金属反应。它跟水反应的化学方程式为IBr+H2O===HBr+HIO。下列关于溴化碘的叙述中正确的是
A.溴化碘中溴和碘的化合价均为0价
B.在化学反应中,溴化碘常用作氧化剂
C.溴化碘与氢氧化钠溶液作用生成NaBrO、NaI、H2O
D.溴化碘与水作用时,既作氧化剂又作还原剂
参考答案:B
本题解析:由于溴的非金属性强于碘,所以IBr中溴呈—1价,碘呈+1价,所以在其于水的反应中没有化合价的升降,即不是氧化剂也不是还原剂。
溴化碘与氢氧化钠溶液:IBr+2NaOH===NaBr+NaIO+H2O
本题难度:简单
5、选择题 下列反应属于氧化还原反应的是
A.3NaOH + FeCl3═Fe (OH)3↓+ 3 NaCl
B.HCl+NaHCO3==NaCl+H2O+CO2↑
C.Cu + 4 HNO3(浓) ==Cu(NO 3)2 + 2 NO2↑+ 2 H2O
3)2 + 2 NO2↑+ 2 H2O
D.CuCl2+2NaOH==Cu(OH)2↓+2NaCl
参考答案:C
本题解析:略
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《燃烧热》试.. | |