微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列化学用语表达不正确的是
A.甲烷的结构式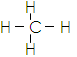
B.丁烷的键线式
C.乙烯的结构简式CH2CH2
D.丙烷的分子式 C3H8
参考答案:C
本题解析:
答案:C
结构简式需突出官能团,乙烯的结构简式CH2=CH2
本题难度:一般
2、选择题 下列有关化学用语表示正确的是
A.石灰乳的化学式:CaO
B.次氯酸的电离方程式:HClO=H+ +ClO-
C.氯离子的结构示意图: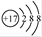
D.中子数为146、质子数为92 的铀(U)原子:14692U
参考答案:C
本题解析:A、石灰乳的主要成分是氢氧化钙,化学式为Ca(OH)2,A不正确;B、次氯酸是弱酸,其电离方程式为HClO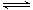 H+ +ClO-,B不正确;C、氯离子的最外层电子数是8个,共有3层,结构示意图为
H+ +ClO-,B不正确;C、氯离子的最外层电子数是8个,共有3层,结构示意图为 ,C正确;D、在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,所以中子数为146、质子数为92 的铀(U)原子质量数=146+92=238,则可表示为
,C正确;D、在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数。因为质子数和中子数之和是质量数,所以中子数为146、质子数为92 的铀(U)原子质量数=146+92=238,则可表示为 ,D不正确,答案选B。
,D不正确,答案选B。
本题难度:一般
3、选择题 在真空密闭装置中,亚氯酸钠(NaClO2)固体在一定条件下发生分解反应,从物质组成的角度看,不可能生成的产物是
A.NaCl和O2
B.NaClO3和NaClO
C.NaClO3和Cl2
D.NaClO3和NaCl
参考答案:C
本题解析:根据亚氯酸钠(NaClO2)中的元素原子个数比1:1:2,可知NaClO3和Cl2不可能得到该比例,Na含量少了。
本题难度:简单
4、填空题 已知制取氯气也可用浓盐酸与高锰酸钾为原料,其化学方程式为
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。请回答下列问题:
(1)用双线桥法标出该化学式电子转移的方向与数目:
2KMnO4+16HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O。
(2)反应中被还原的元素为 (写名称);标准状况下当生成112 L氯气时,反应中转移的电子数目为 。
(3)若有4 molHCl被氧化,则可生成标准状况下的氯气 L。
(4)若有1.58g高锰酸钾和100mL10moL/L浓盐酸充分反应(不考虑盐酸挥发,忽略溶液体积的前后变化),反应至终点时高锰酸钾紫色完全褪去,则被氧化的HCl的物质的量
为 mol。将反应后的溶液取出10mL,加入足量的硝酸银溶液,可得到沉淀的物质的量为 mol。
参考答案:(1)略(2分) (2)锰 (2分) 10NA(2分) (3)44.8L (2分)
(4)0.05mol(2分)0.95(2分)
本题解析:(2)氧化还原反应中,氧化剂,得到电子,化合价降低,被还原,发生还原反应,对应的是还原产物,因此可以分析出被还原的是锰元素。当有5mol的氯气生成时,转移的电子总数为10mol,换成微粒数就是: 10NA。
(3)从方程式上可以看出,反应16mol的盐酸,其中被氧化的只有10mol,转移十摩尔的电子,生成5mol的氯气,因此,若有4 molHCl被氧化,则可生成标准状况下的氯气为2mol ,体保为44.8L 。
(4)1.58g高锰酸钾为0.01mol ,反应中可以看出,每反应2mol的KMnO4,则有10mol的盐酸被氧化,因此,当有0.01mol 的高锰酸钾反应时,被氧化的盐酸的物质的量就为:0.05mol。
2KMnO4+10HCl(浓)+6HCl(浓)=2MnCl2+2KCl+5Cl2↑+8H2O
0.01mol 0.05mol
那么溶液中剩余的氯离子的物质的量为:100mL×10moL/L-0.05mol=0.95mol
将反应后的溶液取出10mL,其中的氯离子的物质的量为0.095mol。加入足量的硝酸银溶液,可得到沉淀的物质的量为0.095mol。
考点:氧化还原的有关知识。
本题难度:一般
5、选择题 120 mL浓度为0.1mol / L的FeSO4溶液,恰好与20 mL浓度为0.1 mol / L的K2X2O7溶液完全反应,则元素X在被还原的产物中的化合价是
A.0
B.+2
C.+3
D.+6