微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 【化学——选修2:化学与技术】(15分)
自来水生产的流程示意图见下:
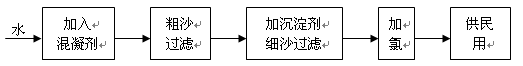
(1)混凝剂除去悬浮物质的过程?(填写序号)
①只是物理变化?②只是化学变化?③是物理和化学变化
FeSO4·7H2O是常用的混凝剂,它在水中最终生成?沉淀。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂填加时先加?后加?,原因是?。
(3)氯气消毒,是因为它与水反应生成了HClO,次氯酸的强氧化性能杀死水中的病菌(不能直接用次氯酸为自来水消毒是因为次氯酸易分解,且毒性较大)。
Cl2+H2O  ?HCl+HClO? K=4.5×10-4
?HCl+HClO? K=4.5×10-4
使用氯气为自来水消毒可以有效地控制次氯酸的浓度,请结合平衡常数解释原因:
?。
下列物质中,?可以作为氯气的代用品(填写序号)。
①?臭氧?②NH3(液)?③K2FeO4?④SO2
(4)有些地区的天然水中含有较多的钙、镁离子。用离子交换树脂软化硬水时,先后把水通过分别装有?离子交换树脂和?离子交换树脂的离子交换柱(填“阴”或“阳”,阳离子交换树脂为HR型,阴离子交换树脂为R’OH型)。
(5)测定水中的溶解氧:量取40mL水样,迅速加入MnSO4和KOH混合溶液,再加入KI溶液,立即塞好塞子,振荡使完全反应。打开塞子,迅速加入适量硫酸溶液,此时有碘单质生成。用0.010mol/LNa2S2O3溶液滴定生成的碘,消耗了6.00mL Na2S2O3溶液。已知在碱性溶液中,氧气能迅速氧化Mn2+,生成物在酸性条件下可以将碘离子氧化为碘单质,本身重新还原为Mn2+。
上述过程发生的反应可表示为:2Mn2++4OH-+O2=2MnO(OH)2
MnO(OH)2+2I-+4H+=I2+Mn2++3H2O? I2+2S2O32- =2I-+S4O62-
则水中的溶解氧量为?mg·L-1。
参考答案:(1)③? Fe(OH)3(各1分)
(2)石灰?纯碱(各1分)?过量的钙离子可通过纯碱使之沉淀下来(2分)
(3)由氯气与水反应的平衡常数可知,该反应的限度很小,生成的HClO浓度很小,且随着HClO的消耗,平衡会不断向正反应移动,补充HClO(2分)?①③(2分)
(4)阳?阴(各1分)?(5)12.0mg·L-1(3分)
本题解析:
(1)③当投加混凝剂时,混凝剂与水作用产生胶体等微絮粒,废水中新生成的微絮粒被迅速吸附在悬浮泥渣上,从而能够达到良好的去除效果。
Fe2++2H2O="Fe" (OH)2+2H+
4Fe (OH)2+O2+2H2O="4Fe" (OH)3
FeSO4·7H2O是常用的混凝剂,它在水中最终生成4Fe (OH)3
(2)石灰?纯碱(各1分)?过量的钙离子可通过纯碱使之沉淀下来(2分)
为了将Mg2+除去,Ca (OH)2须过量,再加过量Na2CO3将Ca2+除去。
(3)Cl2+H2O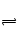 HCl+HClO,该反应为可逆反应,由氯气与水反应的平衡常数可知,该反应的限度很小,生成的HClO浓度很小,且随着HClO的消耗,平衡会不断向正反应移动,补充HClO(2分)
HCl+HClO,该反应为可逆反应,由氯气与水反应的平衡常数可知,该反应的限度很小,生成的HClO浓度很小,且随着HClO的消耗,平衡会不断向正反应移动,补充HClO(2分)
①③可代替Cl2,O3具有强氧化性,Na2FeO4更好,既有强氧化性,又生成Fe (OH)3胶体,具有吸附性,能杀菌消毒,又能净水。
(4)阳?阴
Ca2++2HR=CaR2+2H+然后用酸浸泡,使离子交换树脂再生。
SO42―+2R’OH=R’2SO4+2OH―然后用碱浸泡,使离子交换树脂再生。
(5)解:2Mn2++4OH-+O2=2MnO(OH)2
MnO(OH)2+2I-+4H+=I2+Mn2++3H2O
I2+2S2O32- =2I-+S4O62-
得关系式:O2~2MnO(OH)2~2I2?~4S2O32―
1mol? 4mol
n?0.010mol/L×6.00mL
40mL水样中含氧
n=0.015mmol
现1L水中,m(O)=0.015mmol×32g/mol×1000/40=12.0mg·L-1
本题难度:一般
2、实验题 (11分)铜及其化合物一般都具有特征颜色,例如Cu、Cu2O呈红色,CuO呈黑色、CuSO4·5H2O呈蓝色等。研究性学习小组甲为检测实验室用H2还原CuO所得的红色固体中是否含有 Cu2O进行了认真探究。
Ⅰ.查阅资料:Cu2O属于碱性氧化物;高温灼烧CuO生成Cu2O;Cu2O在酸性条件下能发生下列反应:
Cu2O+2H+===Cu+Cu2++H2O
Ⅱ.设计实验方案:
方案1:取该红色试样溶于足量的稀硝酸中,观察溶液颜色的变化。
方案2:取该红色试样溶于足量的稀硫酸中,观察溶液是否呈蓝色。
方案3:称得干燥坩埚的质量为a g,取红色试样置于坩埚中称得总质量为b g,在空气中高温灼烧至质量恒定,称得最后总质量为c g。
(1)请你评价方案1和方案2。如果你认为该方案合理,请简述其化学原理;如果你认为该方案不合理,请简述原因。
方案1:____________________________________________________________。
方案2:__________________________________________________________。
(2)方案3中,若确认红色粉末中含有Cu2O,则a、b、c应符合的数学的关系为________,该实验方案最少得进行________次称量。
Ⅲ.研究性学习小组乙,设计了新的探究方案,拟通过干燥管中CuSO4是否变蓝判断红色固体中是否含有Cu2O,装置如图所示:
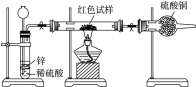
(3)简述该探究方案中,检验气体发生装置气密性的方法(说明操作方法、现象和结论)
________________________________________________________________________。
(4)为确保探究的科学、合理、安全,你认为实验中还应采取的措施有________(填序号)。
A.在氢气发生器与硬质玻璃管之间加一干燥装置
B.加热前先排尽装置中的空气
C.在盛有硫酸铜的干燥管后再连接一个装有碱石灰的干燥管
参考答案:(1)方案1:不合理,因为铜和氧化亚铜均能与稀硝酸反应生成Cu2+,形成蓝色溶液
方案2:合理,因为铜与稀硫酸不反应,氧化亚铜与稀硫酸反应生成Cu和Cu2+,导致溶液呈蓝色
(2)c< 4
(3)关闭导气管上的活塞,从分液漏斗中往试管中注水,使漏斗中的液面高度高于试管中的液面高度,并且一段时间内不回落,说明气体发生装置气密性良好
(4)ABC
本题解析:(1)注意稀硝酸的强氧化性能将铜氧化,而铜与稀硫酸不反应。
(2)设红色试样中含Cu的质量为x。灼烧过程中发生的反应为:
4Cu+O22Cu2O
256? 32
x? c-b
x==8(c-b)
如有Cu2O,则x=8(c-b)<b-a,即c<。
此实验方案至少要称量如下4次:干燥坩埚质量、坩埚加试样质量、灼烧后坩埚和药品总质量、再灼烧后坩埚和药品总质量(此次应与前一次相同方可,为重复实验,说明已加热至恒重)。
本题难度:简单
3、选择题 与近代化学的诞生无关的是
A.化学元素的概念
B.英国化学家、物理学家波义耳
C.著名物理学家爱因斯坦
D.古代的化学实践活动
参考答案:C
本题解析:任何事物是相互联系的,现代化学的产生离不开古代的化学实践活动;1661年,在前人工作的基础上,英国化学家、物理学家波义耳提出化学元素的概念,标志着近代化学的诞生。而爱因斯坦是上一世纪的人物,他出生时,近代化学已诞生两个世纪了。
本题难度:简单
4、选择题 与普通玻璃具有相同组成的是( )
A.钢化玻璃
B.光学仪器玻璃
C.石英玻璃
D.有色玻璃
参考答案:A?
本题解析:钢化玻璃是把普通玻璃放入电炉中加热变软后急剧冷却后得到的,它和普通玻璃的成分相同。光学玻璃中加有PbO,有色玻璃中则加入了金属氧化物
本题难度:简单
5、填空题 (12分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”。为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上。
部分含钒物质在水中的溶解性如下表所示:
物质
| VOSO4
| V2O5
| NH4VO3
| (VO2)2SO4
|
溶解性
| 可溶
| 难溶
| 难溶
| 易溶
|
该工艺的主要流程如下。
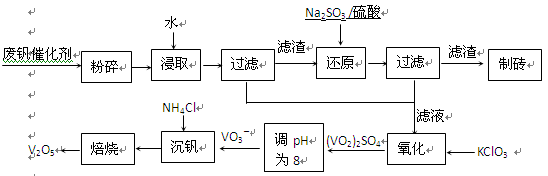
请回答下列问题:
(1)请写出加入Na2SO3溶液发生反应的离子方程式??。
(2)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如下左图)。其中a、c二步的化学方程式可表示为
?,??。
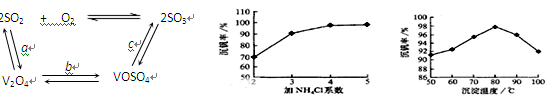
(3)该工艺中沉矾率是回收钒的关键之一,沉钒率的高低除受溶液pH影响外,还需要控制氯化铵系数(NH4Cl加入质量与料液中V2O5的质量比)和温度。根据上右图试建议控制氯化铵系数和温度:?、?。
(4)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变化的曲线如右图所示。则NH4VO3在分解过程中???。

A.先分解失去H2O,再分解失去NH3?
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3?
D.同时分解失去H2、N2和H2O
参考答案:(1)V2O5+ SO32—+4H+=2VO2++SO42—+2H2O
(2)SO2+V2O5 SO3+ V2O4? 4VOSO4+O2
SO3+ V2O4? 4VOSO4+O2 2V2O5+4SO3
2V2O5+4SO3
(3)4和80℃?(4)? B
本题解析:略
本题难度:一般