微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 从化学角度分析,下列叙述不正确的是( ? )
A.利用太阳能蒸馏海水是海水淡化的方法之一
B.研制乙醇汽油技术,可降低机动车辆尾气中有害气体的排放
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅
D.绿色化学的核心是利用化学原理从源头上减少和消除工农业生产等对环境的污染
参考答案:C
本题解析:
本题难度:简单
2、选择题 2007年诺贝尔化学奖授予德国化学家格哈德·埃特尔,以表彰他在界面化学研究领域取得的成就。下面实例中涉及到的变化都属于“界面化学”的范畴。其中正确的是
A.在汽车上安装催化转化器,使一氧化碳在催化剂表面氧化为二氧化碳,可减少一氧化碳的排放
B.泄漏在海洋中的原油可被海洋生物迅速分解而除去
C.铁生锈是铁与空气中的氧气、水蒸气直接化合生成了水合氧化铁(Fe2O3、nH2O)的结果
D.放置在空气中澄清石灰水表面出现的白色固体的主要成分是氢氧化钙
参考答案:A
本题解析:略
本题难度:简单
3、填空题 (18分)目前世界上比较先进的电解制碱技术是离子交换膜法。
(1)在离子交换膜法电解饱和食盐水过程中,与电源正极相联的电极上所发生反应为__________,与电源负极相连的电极附近溶液的pH__________(选填“不变”“升高”“降低”)。
(2)如果粗盐中SO42-含量较高,必须添加试剂除去SO42-,则按添加试剂顺序,依次发生反应的离子方程式为______________________________。
(3)在电解制得的NaOH中往往还含有一定量的NaCl,因此必需进行脱盐工序,脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过__________.冷却.__________(填写操作名称)除去NaCl。
(4)现有阳离子交换膜.阴离子交换膜.石墨电极和如下图所示电解槽,用氯碱工业中的离子交换膜技术原理,可通过电解电解饱和Na2SO4溶液的方法生产NaOH溶液和H2SO4溶液.则电极c为__________极(填“正”.“负”.“阴”.“阳”),b为__________离子交换膜(填“阴”.“阳”)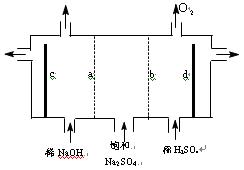
参考答案:(1)2Clˉ-2eˉ="=" Cl2↑(2分)?升高(2分)
(2)Ba2++SO42— = BaSO4↓? CO32—+Ba2+=BaCO3↓? 2H++CO32—= H2O+CO2↑(每个2分,顺序颠倒没分)
(3)蒸发?过滤(每个2分)
(4)阴?阴(每个2分)
本题解析:略
本题难度:一般
4、填空题 【化学——选修2:化学与技术】(15分)
以黄铁矿(主要成分是FeS2)为原料生产硫酸的工艺流程图如下:
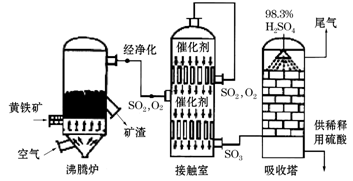
(1)沸腾炉中发生反应的化学方程式为?;接触室中发生反应的化学方程式是?。
(2)沸腾炉出来的炉气需要精制,如果不经过精制,对SO2催化氧化的影响是?
(3)硫酸工业是一种易造成多种形式污染的工业,工业上常采用氨—酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理:?;对矿渣的合理利用方法是?。
(4)某工厂用500t 含硫量为48%的黄铁矿制备硫酸,若在沸腾炉中有2%的FeS2损失,在接触室中SO3的产率为96%,则可得到98%的浓硫酸的质量是?t。
参考答案:(15分)(1)4FeS2+11O2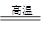 2Fe2O3+8SO2 ;? 2SO2+O2
2Fe2O3+8SO2 ;? 2SO2+O2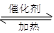 2SO3 (各2分,共4分)
2SO3 (各2分,共4分)
(2)矿尘,砷、硒等化合物导致催化剂中毒,水蒸气对设备和生产有不良影响?(2分)
(3)SO2+2NH3·H2O ===?(NH4)2SO3+ H2O?
(NH4)2SO3+H2SO4===?(NH4)2SO4+SO2↑↑+H2O?;炼铁?(各2分,共6分)
(4)705.6
本题解析:(1)沸腾炉中发生反应的化学方程式为4FeS2+11O2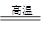 2Fe2O3+8SO2 ;接触室中发生反应的化学方程式为2SO2+O2
2Fe2O3+8SO2 ;接触室中发生反应的化学方程式为2SO2+O2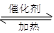 2SO3;
2SO3;
(2)沸腾炉出来的炉气需要精制,如果不经过精制,对SO2催化氧化的影响是矿尘,砷、硒等化合物导致催化剂中毒,水蒸气对设备和生产有不良影响;
(3)硫酸工业是一种易造成多种形式污染的工业,工业上常采用氨—酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理SO2+2NH3·H2O ===?(NH4)2SO3+ H2O;(NH4)2SO3+H2SO4===?(NH4)2SO4+SO2↑↑+H2O ;对矿渣的合理利用方法是炼铁;
(4)某工厂用500t 含硫量为48%的黄铁矿制备硫酸,若在沸腾炉中有2%的FeS2损失,在接触室中SO3的产率为96%,则可得到98%的浓硫酸的质量是705.6t;
本题难度:一般
5、填空题 某城市用水中含c(Ca2+)为1.0×10-3 mol·L-1,c(Mg2+)为5.0×10-4 mol·L-1,c(HCO3-)为8.0×10-4 mol·L-1。如用药剂软化该水1 000 L,应加入Ca(OH)2________g,Na2CO3________g;如果水中含Mg2+,加入Na2CO3后,为尽量减少水中的Mg2+的浓度,可将水加热至沸,加热时反应的化学方程式为________。
参考答案:66.6 116.6?MgCO3+2H2O Mg(OH)2↓+CO2↑+H2O
Mg(OH)2↓+CO2↑+H2O
本题解析:首先要搞清沉淀的关系:
Ca2+→Na2CO3 沉淀为CaCO3
Mg2+→Ca(OH)2 沉淀为Mg(OH)2
HCO3-→Ca(OH)2 沉淀为CaCO3
Ca(OH)2的用途有两个,一是沉淀Mg2+,二是与HCO3-反应生成CO32-,故所消耗Ca(OH)2的质量便可求出:
m[Ca(OH)2]=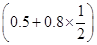 mol×74 g·mol-1=66.6 g
mol×74 g·mol-1=66.6 g
加入Na2CO3的用途自然是沉淀Ca2+,溶液中原有Ca2+为1 mol,又加入了Ca(OH)2的量为0.9 mol,从而使得Ca2+总物质的量为1.9 mol;又因为0.8 mol HCO3-已转化为0.8 mol CO32-,故加入Na2CO3的量应为:
m(Na2CO3)=(1.9-0.8)mol×106 g·mol-1=116.6 g。
本题难度:简单