微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、简答题 (1)49g硫酸的物质的量为______mol,若在水中完全电离可产生______molH+,______molSO42-.若有一定量的硫酸完全电离产生1.806×1024个H+,此硫酸的质量为______g.
(2)标准状况下,11.2L的H2S气体质量为17g,则H2S的摩尔质量是______,相对分子质量为______;?等物质的量的NH3与H2S质量比为______;?1.7g氨气与______mol?H2O含有的电子数相等.
参考答案:(1)49g硫酸的物质的量为n=mM=49g98g/mol=0.5mol,
硫酸为二元酸,则在水中完全电离产生的H+的物质的量为0.5mol×2=1mol,
49g硫酸中,n(SO42-)=0.5mol,
1.806×1024个H+的物质的量为:n(H+)=NNA=1.806×10246.02×1023=3mol,
则:n(H2SO4)=12×n(H+)=12×3mol=1.5mol,
m(H2SO4)=1.5mol×98g/mol=147g,
故答案为:0.5;1;0.5;147g.
(2)标准状况下,11.2L的H2S的物质的量为n=VVm=11.2L22.4L/mol=0.5mol,而质量为17g,
则:M(H2S)=mn=17g0.5mol=34g/mol,
物质的摩尔质量与相对分子质量在数值上相等,则为17,
根据n=mM可知,等物质的量的NH3与H2S质量比等于相对分子质量之比,即17:34=1:2,
1.7g氨气的物质的量为:1.7g17g/mol=0.1mol,
含电子的物质的量为:0.1mol×(7+3×1)=1mol,
则水含有的电子的物质的量也为1mol,一个水分子含有的电子数为(2×1+8)
所以水的物质的量为1mol2×1+8=0.1mol,
故答案为:34g/mol;34;1:2;0.1mol.
本题解析:
本题难度:一般
2、选择题 某硫酸铝溶液中含 Al3+ ag? ,则溶液中 SO42-的物质的量为?(?)
A. mol
mol
B.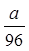 mol
mol
C.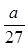 mol
mol
D.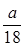 mol
mol
参考答案:D
本题解析:铝离子的物质的量是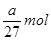 ,根据化学式Al2(SO4)3可知, SO42-的物质的量为
,根据化学式Al2(SO4)3可知, SO42-的物质的量为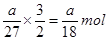 ,答案选D。
,答案选D。
本题难度:一般
3、计算题 实验室需要0.1 mol /L氢氧化钠溶液100 mL,现有2 mol /L氢氧化钠溶液。
(1)计算所需溶质氢氧化钠的质量是多少?
(2)计算所需2 mol /L氢氧化钠溶液的体积;
参考答案:
本题解析:
本题难度:一般
4、选择题 设NA表示阿伏加德罗常数值,下列叙述正确的是(? )
A.NA个氧气分子和NA个氢气分子的质量比为16∶1
B.54g H2O中含有的水分子数为3NA个
C.11.2L 氯气中含有的原子数为NA个
D.2L 1mol/L Na2SO4溶液中Na+离子数为2NA个
参考答案:AB
本题解析:在相同条件下,气体的分子数之比是物质的量之比,所以A正确。54g水是3mol,B正确。C中没有指明温度和压强,不正确,D中应该是4NA个,答案选AB。
本题难度:一般
5、选择题 若NA表示阿伏加德罗常数,下列说法正确的是:
A.1mol H2O2含有极性共价键为NA,含有非极性键为2NA
B.2mol SO2和1mol O2在密闭容器中加热(V2O5催化)充分反应后,容器内分子总数为2NA
C.1molFeCl3完全转化为Fe(OH)3胶体后生成NA个胶粒
D.将0.1mol Cl2与足量NaOH溶液在常温下充分反应,转移的电子数为0.1NA
参考答案:D
本题解析:A、1mol H2O2含有极性共价键为2NA,含有非极性键为NA。B SO2和O2反应生成SO3是一个可逆反应,充分反应后该反应仍不能进行完全,故容器内的分子总数大于2NA。C选项1molFeCl3完全转化为Fe(OH)3胶体后生成胶粒个数小NA。D选项发生的反应为: Cl2+2NaOH=NaCl+NaClO+H2O, 该反应是一个歧化反应,既是氧化剂又是还原剂,所以Cl20.1mol Cl2与足量NaOH溶液在常温下充分反应,转移的电子数为0.1NA
点评:本题属于高考中的常见题型,主要是将各个部分的知识与物质的量一起考察,本题难度一般,但需要学生熟悉各个部分的知识。需要学生对阿伏伽德罗常数的有较多的理解与应用,在解题时,需要注意气体体积是否是在标准状况下的,还有反应物是否有过量等。
本题难度:一般