| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学必考知识点《气体的净化、干燥、吸收与收集》试题强化练习(2017年最新版)(四)
(2)由溶液C获得CuSO4·5H2O,需要经过加热浓缩,? ,过滤等操作。除烧杯、漏斗外,过滤操作还需用到另一玻璃仪器,该仪器在此操作中的主要作用是 。 (3)制备CaCO3时,发生反应的化学方程式是? ?;若实验过程中有氨气逸出,可选用下列装置中的? ?(填代号)装置吸收氨气。 (烧杯中的液体都为水) 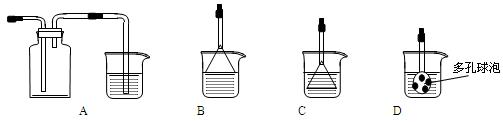 (4)欲测定溶液A中Fe2+的浓度,需配制100 mL 0.1 mol∕LKMnO4标准溶液。配制该溶液时:除烧杯、玻璃棒、胶头滴管外,还需的一种玻璃仪器是? ?;当往该玻璃仪器中加蒸馏水至接近刻度线1-2cm时,应改用 滴加蒸馏水至溶液的凹液面正好与刻度线相平。 参考答案:(每空2分,共16分) 本题解析:略 本题难度:一般 2、选择题 下列气体中,不能用排水法收集的是(?) 参考答案:C 本题解析:用排水法收集气体要求气体不能与水反应且难溶于水,NO2与水反应生成硝酸和一氧化氮。故不能用排水法收集。 本题难度:简单 3、实验题 有下列实验装置如图: 参考答案:(1)在A中放入少量水,使水面刚浸没长颈漏斗下端,打开旋塞a,在烧瓶B底部稍加热,若在A漏斗颈内水面上升,且E中导管口有气泡逸出,表示装置不漏气。 本题解析:本题综合考查了实验装置气密性的检查、氢气纯度的检验及NH3的合成等知识。 本题难度:一般 4、填空题 锌钡白是一种白色颜料。工业上是由ZnSO4与BaS溶液混合而成:BaS+ZnSO4=ZnS↓+BaSO4↓。请根据以下工业生产流程回答有关问题。 |

参考答案:(共16分)
(1)(4分)SiO2(2分)? B(2分)
(2)(3分)Fe(OH)3、Cu(OH)2(2分)?①(1分)
(3)(4分)OH-+CO2= HCO3-(2分)、ZnO22-+ 2CO2 + 2H2O = Zn(OH)2↓ + 2HCO3-(2分)
(4)(3分)BaSO4(s) + 4C(s) =" BaS(s)" + 4CO(g)?△H =" +571.2" kJ?mol-1
(5)(2分)过量的酸与BaS溶液混合会产生有毒的H2S气体污染空气(1分),而且锌钡白的产率会降低(1分)
本题解析:(1)ZnCO3、FeCO3、Cu2(OH)2CO3都能溶于足量5mol/LH2SO4溶液,符合复分解反应发生的条件,生成ZnSO4、FeSO4、CuSO4、CO2气体、H2O,而SiO2则不溶于硫酸,则步骤①酸浸之后所得滤渣1的化学式为SiO2,滤液1的主要成分是ZnSO4、FeSO4、CuSO4、H2O;步骤②中用Cl2能氧化Fe2+,但会引入新的杂质(Clˉ、Cl2),且过量的氯气有毒,故A错误;H2O2能氧化Fe2+,还原产物是H2O,不会引入新杂质,且过量H2O2受热易分解为水和氧气,故B正确;KMnO4能氧化Fe2+,但是会引入新的杂质(K+、Mn2+、KMnO4),故C错误;浓HNO3能氧化Fe2+,还原产物是有毒的NO2,且能引入新的杂质(NO3ˉ、HNO3),故D错误;(2)步骤②氧化后所得溶液的主要成分是ZnSO4、Fe2(SO4)3、CuSO4,都能与过量NaOH溶液反应,根据题意可知滤液2的主要成分是Na2ZnO2、NaOH,滤渣2的主要成分是Fe(OH)3、Cu(OH)2;步骤④中的CO2气体来自步骤①酸浸反应放出的气体,可以节能减排;(3)偏铝酸钠溶液通入过量CO2气体可以制氢氧化铝沉淀,由此推断步骤④发生的反应为Na2ZnO2、NaOH溶液分别与CO2气体的反应,NaOH+CO2=NaHCO3,Na2ZnO2+2H2O+2CO2=Zn(OH)2↓+2NaHCO3,则滤渣3为Zn(OH)2,滤液3的主要成分为NaHCO3;(4)根据盖斯定律,由②×4+③-①可以约去Ba(s)、S(s)、2O2(g),得到的热化学方程式为:BaSO4(s) + 4C(s) =" BaS(s)" + 4CO(g)?△H =" +571.2" kJ?mol-1;(5)若步骤⑤为Zn(OH)2与过量硫酸的中和反应,所得溶液的主要成分为ZnSO4、H2SO4,ZnSO4、H2SO4溶液与BaS(s)混合时不仅可以制取锌钡白,而且过量的H2SO4与易与BaS(s)发生复分解反应,生成有毒的H2S气体,既导致空气污染,又减少锌钡白的产量。
本题难度:一般
5、实验题 (12分)NaClO2用于棉、麻、粘胶纤维及织物的漂白。实验室制备NaClO2的装置如下图所示: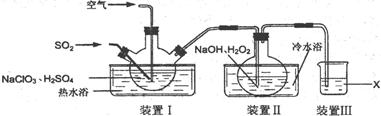
(1)装置I控制温度在35~55℃,通入SO2将NaClO3还原为ClO2(沸点:11℃),反应结束后通入适量的空气,其目的是???。
(2)装置Ⅱ中反应生成NaClO2的化学方程式为???。反应后的溶液中阴离子除了ClO2-、ClO3-、Cl-、ClO-、OH—外还可能含有的一种阴离子是??,检验该离子的方法是??
(3)已知在NaClO2饱和溶液中温度低于38℃时析出晶体是NaClO2·3H2O,温度高于38℃时析出晶体是NaClO2,温度高于60℃时NaClO2分解生成NaClO3和NaCl。请补充从装置Ⅱ反应后的溶液中获得NaClO2晶体的操作步骤。
①减压,55℃蒸发结晶;②??;③??;④??;得到成品。
(4)装置Ⅲ中试剂X为??。
参考答案:(1)将ClO2吹入到装置Ⅱ进行反应(2分)
(2)2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2(2分)
SO42-(1分)?取少量反应后的溶液,先加足量的盐酸,再加BaCl2溶液,若产生白色沉淀,则说明含有SO42-(2分)
(3)②趁热过滤(1分)③用38℃~60"℃热水洗涤(1分)④低于60"℃干燥(1分)
(4)NaOH溶液(合理答案均可)(2分)
本题解析:(1)因为装置I中生成ClO2,为了提高原料的利用率,需要利用空气将生成的ClO2吹入到装置Ⅱ进行反应。
(2)ClO2既有氧化性,可将双氧水氧化成氧气,而自身被还原生成NaClO2,方程式为2NaOH+2ClO2+H2O2=2NaClO2+2H2O+O2。由于进入装置Ⅱ的气体会混有二氧化硫气体,二氧化硫被氧化生成硫酸。检验SO42-一般用盐酸酸化的加BaCl2溶液。
(3)根据所给信息可知,要想得到NaClO2晶体,关键是控制温度。温度太高或太低均会产生杂质。
(4)由于在反应中会产生ClO2、SO2等大气污染物,所以需要尾气处理。
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点总结《有机化学反.. | |