洗气
参考答案:B
本题解析:略
本题难度:简单
2、填空题 (6分)在下图所示的实验装置中,A中盛有品红溶液,B 中盛有NaOH溶液。
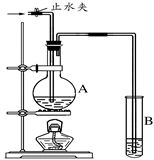
请回答下列问题:
(1) 若向A中通入足量的二氧化硫气体,A中的现象是?。
(2) 若向A中通入足量的氯气后,再加热A,A中的溶液?
(填“能”或“不能”)恢复到原来的颜色。
参考答案:(1) 溶液由红色变为无色(或褪色)(2分),但加热后溶液恢复红色(1分)
(2) ?不能?(3分)
本题解析:(1)SO2可与有色物质结构生成不稳定的无色物质,具有漂白性,可使品红溶液褪色,但加热后,无色物会恢复原色,重新恢复为红色
(2)氯气可与水生成具有强氧化性的HClO,它具有漂白性,并且不可逆,加热也不能恢复原色
本题难度:简单
3、实验题 单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
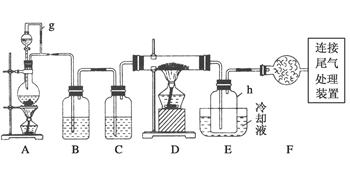
相关信息如下:
a.四氯化硅遇水极易水解;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质
| SiCl4
| BCl3
| AlCl3
| FeCl3
| PCl5
| 沸点/℃
| 57.7
| 12.8
| —
| 315
| —
| 熔点/℃
| -70.0
| -107.2
| —
| —
| —
| 升华温度/℃
| —
| —
| 180
| 300
| 162
|
请回答下列问题:
(1)写出装置A中发生反应的离子方程式______________________。
(2)装置A中g管的作用是________;装置C中的试剂是________;装置E中的h瓶需要冷却的理由是__________________________________。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是________(填写元素符号)。
参考答案:(1)MnO2+4H++2Cl-△Mn2++Cl2↑+2H2O
(2)平衡压强,使液体顺利流出并防止漏气 浓硫酸 产物SiCl4沸点低,需要冷凝收集
(3)Al、P、Cl
本题解析:略
本题难度:一般
4、实验题 (20分)某化学课外活动小组以铝屑、稀H2SO4、NaOH溶液为主要原料欲制备Al(OH)3沉淀,设计了如下三种方案,见下表。阅读下表并回答下列问题:
途径
| 生成1 mol Al(OH)3消耗H+或OH-的物质的量/mol
| 消耗H+
| 消耗OH-
| 1.Al→Al3+→Al(OH)3
| ?
| ?
| 2.Al→AlO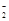 →Al(OH)3 →Al(OH)3
| ?
| ?
| 3.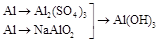
| ?
| ?
|
(1)填写上表中空格并从节约原料的角度来分析,你认为应选择方案_________最为合理。
(2)本实验要用到NaOH溶液。某学生用已知质量y(g)的表面皿,准确称取 (g)NaOH固体。他在托盘天平的右盘上放入( (g)NaOH固体。他在托盘天平的右盘上放入( + y)(g)砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边,如图所示,下面他的操作应该是_________?使?。 + y)(g)砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边,如图所示,下面他的操作应该是_________?使?。
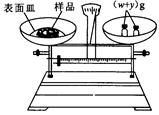
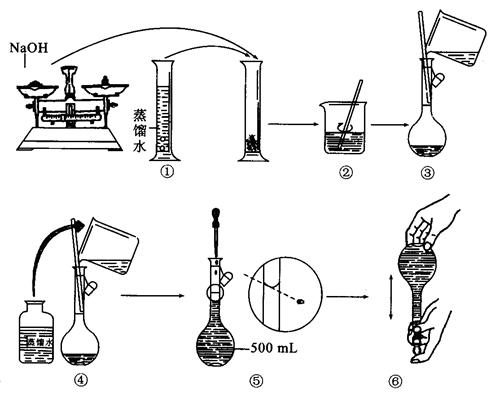
(3)若称取的 (g)NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制溶液过程示意图中有错误的是(填操作序号)______________。 (g)NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制溶液过程示意图中有错误的是(填操作序号)______________。
(4)阅读下列制备Al(OH)3实验步骤,填写空白:
①在烧杯A中加入50mL0.5mol·L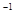 NaOH溶液,再加入足量铝屑。给溶液稍加热。其作用是:__________________________用蒸馏水把铝屑冲洗干净。称量铝屑的质量为m1(g)。 NaOH溶液,再加入足量铝屑。给溶液稍加热。其作用是:__________________________用蒸馏水把铝屑冲洗干净。称量铝屑的质量为m1(g)。
②在盛有适量稀H2SO4的烧杯B中应放入___________(g)(用含m1的式子表示)质量的铝屑,充分搅拌使铝屑反应完全。
③在盛有适量浓NaOH溶液的烧杯C中放入____________(g)(用含m1的式子表示)质量的铝屑充分搅拌使铝屑反应完全。
④将烧杯B和烧杯C中的溶液混和观察到的现象是:_______________________________,反应的离子方程式是:___________________________
(5)过滤时某学生操作如图,请用文字说明图中错误的是:
_____________________?。

(6)把沉淀转移到烧杯中,用蒸馏水洗涤三次再过滤,再洗涤、
干燥得Al(OH)3固体质量为m2(g)计算本实验Al(OH)3的产率是_________________?
参考答案:
(1)
途径
生成1 mol Al(OH)3消耗H+或OH-的物质的量/mol
消耗H+
消耗OH-
1
3
3
2
1
1
3
3/4
3/4
?
方案3(每空1分,共7分)
(2)继续加入样品?指针指在标尺的中间(2分)?(3)①③④⑤?(2分)
(4)①除去铝粉表面的Al2O3;② ;③ ;③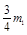 ?(共3分)④生成白色絮状沉淀? 3AlO ?(共3分)④生成白色絮状沉淀? 3AlO ??4Al(OH)3↓(共2分)(5)玻璃棒下端应该低于滤纸边缘;漏斗颈没有(或应该)靠在烧杯内壁.(共2分)
(6)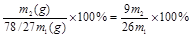 ?(2分) ?(2分)
本题解析:(1)根据方程式2Al+6H+=2Al3+3H2↑、Al3++3OH-=Al(OH)3↓、↓2Al+2OH-+2H2O=2AlO2-+3H2↑、Al2-+H++H2O=Al(OH)3↓、3AlO ??4Al(OH)3↓,即可计算出消耗的氢离子或OH-的物质的量。根据消耗的原料分析,方案3是最好的。
(2)指针偏向右边,说明样品的质量还不到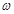 g,所以应该继续加入样品,使指针指在标尺的中间。 g,所以应该继续加入样品,使指针指在标尺的中间。
(3)考查物质的量浓度溶液的配制,溶解应该在烧杯中进行,①不正确。转移使,胶头滴管的下端应该放在刻度线的下面,③不正确。④不正确,因为没有洗涤,⑤不正确,定容时应该平视,
答案选①③④⑤。
(4)①铝片表面含有氧化铝,需要氢氧化钠除去。
②根据3AlO ??4Al(OH)3↓可知,生成铝离子的消耗的铝,和生成AlO2-消耗的铝质量之比是1︰3的,所以B中应放入 的铝。 的铝。
③根据②可知C中放入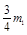 的铝。 的铝。
④铝离子和AlO2-反应生成氢氧化铝沉淀。方程式为3AlO ??4Al(OH)3↓。
(5)根据装置图可知,有2处错误,分别是玻璃棒下端应该低于滤纸边缘;漏斗颈没有(或应该)靠在烧杯内壁。
(6)m1g理论上可生成氢氧化铝是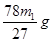 ,所以产率是 ,所以产率是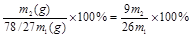 。 。
本题难度:一般
5、填空题 实验室要用98%(ρ=1.84g·cm-3)的硫酸配制3.68mol·L-1的硫酸溶液500mL
(1)需准确量取98%的硫酸 ?mL。
(2)准确量取一定体积的98%的硫酸后,要配制3.68mol·L-1的硫酸溶液500mL,必须用到的实验仪器是(填写序号):??.
①500mL量筒?②烧杯?③1000mL容量瓶?④500mL?容量瓶
⑤天平?⑥胶头滴管?⑦锥形瓶?⑧玻璃棒?
(3)若配制3.68mol·L-1的硫酸溶液的其他操作均正确,但出现下列错误操作,将例所配制的硫酸溶液浓度的影响(偏高,偏低,或不变)
A.将稀释的硫酸溶液转移至容量瓶后,未洗涤烧杯和玻璃棒
B.将烧杯内的稀硫酸向容量瓶中转移时,因操作不当使部分稀硫酸溅出瓶外。
C.用胶头滴管向容量瓶中加水时溶液凹液面高于容量瓶刻度,此时立即用滴管将瓶内液体吸出,使溶液凹液面与刻度相切。
D.用胶头滴管加水时,仰视观察溶液凹液面与容量瓶刻度相切。
参考答案:(1)100mL。(2)②④⑥⑧(3)A偏低B?偏低?C ?偏低D?偏低
本题解析:欲配制500mL的溶液,需用500mL的容量瓶。(1)需准确量取98%的硫酸的体积v=0.5L×3.68mol·L-1×98g/mol÷98%÷1.84g·cm-3=100mL;(2)量取98%的硫酸后,倒入烧杯,稀释,用玻璃棒进行搅拌,冷却至室温,转移入500mL?容量瓶,洗涤,定容,当距离刻度线1-2cm时改用胶头滴管,摇匀,则配制了一定浓度的溶液。故需用到的实验仪器有烧杯、玻璃棒、500mL?容量瓶和胶头滴管;(3)A烧杯和玻璃棒上面粘附有溶质,若没有洗涤或洗涤后洗涤液没有加入容量瓶,都会使所配制的溶液的浓度偏低;B部分稀硫酸外溅,溶质减小,故浓度偏低;C若加入过多的水,则使溶液的浓度偏小,将瓶内液体吸出,会吸出少量溶质,故溶液最终的浓度还是偏低,当加入过量的水时,只能倒掉重新配制;D 仰视时,溶剂过量,溶液的浓度偏低。
点评:对化学实验的考查是历年的高考重点,考生在备考中应注意对化学实验、化学仪器的相关知识的积累。
本题难度:一般
|