微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 (8分)
用实 验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。其具体实验步骤如下:
验室准确配制的0.100mol/L的NaOH溶液测定某未知浓度的稀盐酸。其具体实验步骤如下:
①取一支碱式滴定管(如图有两只滴定管,你选择哪一只?)?(填写对应字母),用少量标准NaOH溶液润洗2~3次水洗后的碱式滴定管,再加入标准的0.100mol/L的NaOH溶液并记录液面刻度读数;

②用酸式滴定管精确地放出25.00mL待测盐酸,置于用蒸馏水洗净的锥形瓶中。再加入酚酞试液2滴;
③滴定时,边滴边振荡,同时眼睛注视锥 形瓶内溶液颜色的变化,当锥形瓶内溶液由
形瓶内溶液颜色的变化,当锥形瓶内溶液由
?(填写颜色变化)且半分钟内不褪色时,即达到滴定终点;
④记录液面刻度读数。根据滴定管的两次读数得出消耗标准盐酸的体积,再重复测定两次,实验结果记录见下表:
实验次数
| 起始滴定管读数
| 终点滴定管读数
|
1
| 0.00mL
| 24.02mL
|
2
| 0.50mL
| 24.46mL
|
3
| 1.00mL
| 25.02mL
|
测得未知稀盐酸的物质的量浓度为?(保留小数点后3位)。
⑤如果滴定结束时俯视碱式滴定管刻度读数(其它操作均正确),则对滴定结果稀盐酸浓度的影响是?(填“偏高”、“偏低”或“无影响”)。
2、实验题 (14分)某化学兴趣探究小组将一批废弃的线路板简单处理后,得到含Cu(70%)、Al(25%)、Fe(4%)及少量Au、Pt等金属的混合物,并设计出如下制备硫酸铜和硫酸铝晶体的路线:
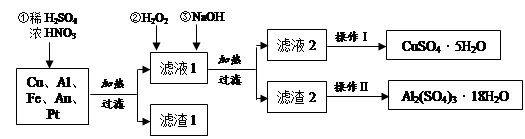
(1)在金属混合物与酸的反应中,表现氧化性的离子为?;得到滤渣1的主要成分为?。
(2)第②步加H2O2后发生反应的离子方程式为?;
通过加入NaOH调节溶液的pH,其目的是?;
(3)操作Ⅰ中包括的实验步骤有?、过滤;
(4)通过操作Ⅱ可以由滤渣2制取Al2(SO4)3·18H2O 。下列是操作Ⅱ的一种实验方案。

实验中:试剂1是?,试剂2是?。(填化学式)
3、实验题 (14分)下图为实验室制取纯净、干燥的Cl2,并进行检验Cl2性质实验的装置。其中E瓶中放有干燥红色布条;F中为铜网,F右端出气管口附近放有脱脂棉。
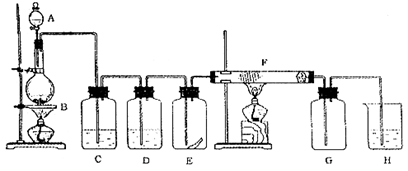
试回答:
(1)A中所放试剂为?,B中所放试剂为?,二者反应的化学方程式为?,
(2)为得到干燥纯净的氯气,一般在C瓶中加入?试剂,D瓶中加入?试剂。
(3)E瓶中现象为?; F中反应的化学方程式为?。
(4)H中应加入的试剂为?,其作用是?。
其化学方程式为?。
4、实验题 下图是实验室中制备气体或验证气体性质的装置图
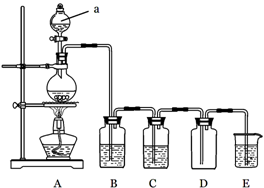
(1)仪器a的名称是?。
(2)利用上图装置制备纯净、干燥的氯气。
①圆底烧瓶内发生反应的离子方程式为?。
②装置B中的溶液为?;烧杯中溶液的作用为?。
(3)利用上图装置证明SO2具有漂白性、还原性及生成气体中含有CO2。
圆底烧瓶内加入碳,a中加入浓硫酸,B、D中匀为少量品红溶液,C中为足量酸性高锰酸钾溶液,E中为澄清石灰水。
①证明SO2具有漂白性的装置是?,现象是?;
②证明SO2具有还原性的现象是?;
③证明生成气体中含有CO2的现象是?;
④D装置的作用是?。
5、推断题 (12分) 以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:

(1)图中“沉铁”化学方程式为?。
(2)图中“过滤”后滤液中金属阳离子除了含有的Al3+,还含有??(填化学式)。
(3)加30%的H2O2溶液发生的离子反应方程式为?。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O] 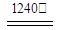 2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过图9所示的装置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过图9所示的装置。


①集气瓶中收集到的气体是??(填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有??(填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为?。