微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如下图所示。则下列有关说法中,不正确的是
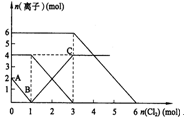
A.还原性:I— >Fe2+>Br—
B.原混合溶液中FeBr2的物质的量为6mol
C.当通入2molCl2时,溶液中已发生的离子反应可表示为:
2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-
D.原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
参考答案:B
本题解析:
两个基本反应为:2Fe2++Br2═2Fe3++2Br-,2Fe3++2I-═2Fe2++I2.
A.反应2Fe2++Br2=2Fe3++2Br-中,还原剂Fe2+的还原性强于还原产物Br-,所以还原性:Fe2+>Br-,反应2Fe3++2I-=2Fe2++I2中,还原剂I-的还原性强于还原产物Fe2+,所以还原性:I->Fe2+,所以还原性I->Fe2+>Br-,故A正确;
B.通入氯气后,碘离子先被氧化,其次是亚铁离子,最后是溴离子,在通入氯气的量为0~1mol的过程中,碘离子从最大量降到0,即得到碘离子的物质的量为2mol,通入氯气的量为1~3mol的过程中,亚铁离子从4mol降到0,三价铁的量逐渐增大,所以含有亚铁离子共4mol,在通入氯气的量为3~6mol的过程中溴离子从6mOl降到0,所以溴离子的物质的量是6mol,即FeBr2的物质的量为3mol,故B错误;
C.当通入2molCl2时,2mol的I-消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应可表示为2Fe2++2I-+2Cl2=2Fe3++I2+4Cl-,故C正确;
D.由B可知,碘离子的物质的量为2mol,亚铁离子是4mol,溴离子的物质的量是6mol,n(Fe2+):n(I-):n(Br-)=2:1:3,故D正确.
故选B.
本题难度:一般
2、选择题 将Cl2制成漂粉精的主要目的是
A.增强漂白和消毒作用
B.使它转化为较稳定物质,便于保存和运输
C.使它转化为较易溶于水的物质
D.增加氯的质量分数,有利于漂白、消毒
参考答案:B
本题解析:氯气和漂白精的作用都是生成次氯酸,然后具有漂白性。因氯气不方便保存和运输,故通入石灰乳中制成漂白精,答案选B。
本题难度:一般
3、选择题 下列关于氯水的叙述不正确的是 (? )
A.氯水滴加到AgNO3溶液中会产生白色沉淀
B.氯水通常应在阴凉处置于棕色细口瓶中密封保存
C.新制氯水可使蓝色石蕊试纸先变红后褪色
D.新制氯水放置数天后溶液的酸性减弱
参考答案:D
本题解析:Cl2+H2O HCl+HClO
HCl+HClO
A?正确,氯水中存在氯离子,加AgNO3溶液会出现白色沉淀
B?正确,氯水中存在HClO,HClO见光易分解,氯水通常应在阴凉处置于棕色细口瓶中密封保存
C?正确,氯水显酸性,可以使蓝色石蕊试纸先变红,氯水有漂白性,又可以使红色褪去。
D?久置氯水的主要成分是盐酸,酸性增强。
本题难度:一般
4、选择题 某化学实验的尾气中含有较多的氯气。要吸收这些尾气,下列试剂中最合适的是
[? ]
A.烧碱溶液
B.饱和石灰水
C.自来水
D.食盐水
参考答案:A
本题解析:
本题难度:简单
5、选择题 下列化学实验事实及其结论都正确的是(?)
选项
| 实验事实
| 结论
|
A
| 将SO2通入含HClO的溶液中生成H2SO4
| HClO的酸性比H2SO4强
|
B
| 铝箔在酒精灯火焰上加热熔化但不滴落
| 铝箔表面氧化铝熔点高于铝
|
C
| 稀、浓硝酸分别与铜反应,还原产物分别为NO和NO2
| 稀硝酸氧化性比浓硝酸强
|
D
| 将SO2通入溴水中,溴水褪色
| SO2具有漂白性
参考答案:B
本题解析:A.将SO2通入含HClO的溶液中生成H2SO4, 是因为HClO的氧化性比H2SO4强,能够把SO2氧化为H2SO4。错误。B.铝箔在酒精灯火焰上加热熔化但不滴落,是由于加热时在金属表面产生了熔点高于铝的氧化铝,包裹在熔化的Al的外边,是其不至于滴落。正确。C.稀、浓硝酸分别与铜反应,还原产物分别为NO和NO2,是浓硝酸氧化性比稀硝酸强,它把NO又氧化为NO2。错误。D.将SO2通入溴水中,溴水褪色,是由于发生反应Br2+2H2O+SO2= SO42-+4H++2Br-,这是SO2的还原性。错误。
本题难度:简单
|