微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题
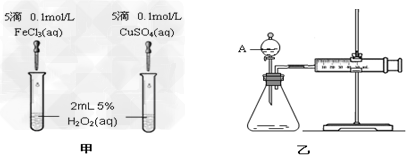
(1)定性分析:如图甲可通过观察_____________,定性比较得出结论。有同学提出将
FeCl3改为Fe2(SO4)3更为合理,其理由是_____________________,
(2)定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。图中仪器A的名称为__________,检查该装置气密性的方法是_____________,实验中需要测量的数据是______________。
(3)加入0.10?mol?MnO2粉末于50?mL?H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图所示。
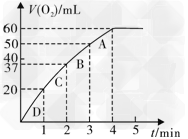
①写出H2O2在二氧化锰作用下发生反应的化学方程式______________________。
②实验时放出气体的总体积是___________mL。
③放出?气体所需时间为__________min。
④反应放出?气体所需时间约为__________min。
⑤A、B、C、D各点反应速率快慢的顺序为_____>____>____>____。
⑥解释反应速率变化的原因__________。
⑦计算H2O2的初始物质的量浓度_____________。?(请保留两位有效数字)
参考答案:(1)产生气泡的快慢;消除阴离子不同对实验的干扰
(2)分液漏斗;关闭分液漏斗的活塞,将注射器活塞向外拉出一段,过一会后看其是否回到原位;产生40mL气体所需的时间
(3)①2H2O2 2H2O + O2↑;②60 mL;?③1 min;④2.5?min;?⑤D>C>B>A; ⑥随着反应的进行,浓度减小,反应速率减慢;⑦ 0.11 mol·L-1
2H2O + O2↑;②60 mL;?③1 min;④2.5?min;?⑤D>C>B>A; ⑥随着反应的进行,浓度减小,反应速率减慢;⑦ 0.11 mol·L-1
本题解析:
本题难度:一般
2、实验题 (14分)某研究小组对铁生锈进行研究:

(1)经过较长时间后,甲同学观察到的现象是:上图中的铁钉最容易生锈的是?(填字母),铁锈的主要成分是?
(2)根据实验条件判断,在铁钉的锈蚀过程中,正极的电极反应为?
(3)铁生锈的外部条件是??;在此条件下,铁钉发生吸氧腐蚀转化为Fe(OH)2的电池反应方程式为?
(4)若为了防止铁钉生锈,该小组同学想在铁钉表面镀上一层金属,该金属最好是?
A. 锡? B. 铜? C. 锌?
(5)钢铁容易腐蚀,工业生产中常需对钢铁进行“发蓝”处理,以有效避免或减缓钢铁的腐蚀。所谓“发蓝”,就是在钢铁零件等进行氧化处理,使其表面形成一层致密的蓝黑色氧化膜。发蓝处理过程可表示如下:

①步骤Ⅲ用除锈液(15%的硫酸溶液)浸泡铁件的目的在于除去铁表面的铁锈,该步反应的离子方程式为___________________________________。
②为检验经过步骤Ⅳ处理的铁件是否合格,常往成品表面滴上5%的硫酸铜溶液,如果成品不合格(即铁件表面有微小松孔,未形成致密的氧化膜),一段时间将观察到的现象为__________________________。
③除锈后的铁件在发蓝液(NaNO2、NaNO3及NaOH组成的混合液)中浸泡(步骤IV),发生了复杂的化学反应:
反应一:____Fe +____NaNO2 +___NaOH —____Na2FeO2 +____H2O +___NH3↑
反应二:8Fe+3NaNO3 + 5NaOH + 2H2O = 4Na2Fe2O4 + 3 NH3↑
反应三:Na2FeO2 + Na2Fe2O4 + 2H2O = Fe3O4 + 4NaOH
配平“反应一”的化学方程式(将系数直接填在横线上)。若要循环使用发蓝液,从理论角度分析,需要往使用过的发蓝液中_________
A. 只需加入NaNO2? B. 只需加入NaNO2和NaNO3
C. 需要加入NaNO2、NaNO3和NaOH? D. 不需加入任何物质而直接使用
参考答案:(14分)(1)A,? Fe2O3(或 Fe2O3· xH2O)
(2)O2+2 H2O+4e-= 4 OH-
(3)潮湿的空气(或氧气与水);? 2Fe +O2 +2 H2O=2 Fe(OH)2
(4)C?(5)① Fe2O3+6 H+=2 Fe3++3 H2O
②铁制品表面有红色固体析出③ 3、1、5、3、1、1;B
本题解析:(1)B、C都不能隔绝空气,防止铁发生电化学腐蚀,而A不能,所以最容易倍腐蚀的是A。铁锈的主要成分是Fe2O3(或 Fe2O3· xH2O)。
(2)在铁的电化学腐蚀中,铁作负极,由于溶液的酸性很弱,所以正极是氧气得到电子,即反应式为O2+2 H2O+4e-= 4 OH-。
(3)铁要腐蚀电化学腐蚀,则必须处在潮湿的空气(或氧气与水),反应的总反应式是2Fe +O2 +2 H2O=2 Fe(OH)2.
(4)由于镀层一旦败损之后容易腐蚀电化学腐蚀,所以作镀金属性比铁强的金属,所以答案选C。
(5)①铁锈的主要成分是氧化铁,和稀硫酸反应的方程式为Fe2O3+6 H+=2 Fe3++3 H2O。
②因为铁的活泼性强于铜,铁能和硫酸铜反应置换出铜,所以铁制品表面有红色固体析出。
③在反应中铁失去电子作还原剂,化合价从0价升高到+2价。氧化剂是亚硝酸钠,氮元素的化合价从+3价降低到-3价,变化6个单位,即氧化剂和还原剂的物质的量之比是1︰3的,所以方程式为3Fe +NaNO2 +5NaOH=3Na2FeO2 +H2O +NH3↑。将3个反应合并即得到12Fe+NaNO3+4NaNO2+10H2O=4Fe3O4+5NH3↑+5NaOH,这说明反应中消耗的是硝酸钠和亚硝酸钠,所以需要补充二者,答案选B。
本题难度:一般
3、实验题 已知过氧化钠与水的反应分两步进行,第一步是过氧化钠与水反应生成过氧化氢和氢氧化钠;第二步是过氧化氢分解生成水和氧气。某校合作学习探究小组对过氧化钠与水的反应进行了再探究。将过氧化钠与一定量的水反应,有气泡放出,将所得的浓溶液分成四份,分别进行实验探究:

试回答:
(1)按要求写出下列反应的化学方程式:
①过氧化钠与水反应生成过氧化氢和氢氧化钠:_______________________________。
②在二氧化锰作用下过氧化氢发生分解反应:_______________________________。
(2)根据B、D两个实验,回答D实验中酚酞试液不变红的原因是_____________________________。
(3)综合考虑,回答A实验中酚酞试液不变红的原因可能是:
①_______________________;②_________________________。
参考答案:(1)①Na2O2+2H2O==2NaOH+H2O2;②2H2O2 2H2O+O2↑
2H2O+O2↑
(2)H2O2有漂白性(或强氧化性)
(3)H2O2有漂白性(或强氧化性);NaOH的浓度大或OH-的浓度大
本题解析:
本题难度:困难
4、简答题 某同学设计了图所示装置(夹持仪器省略)进行系列实验,实验时将药品A逐滴加入到固体B中,请回答:
(1)若A为浓氨水,B为烧碱,C为AlCl3溶液,打开分液漏斗旋塞,烧瓶中即有氨气生成,
原因是______(结合离子方程式回答).一段时间后,观察到试管中的现象是______,
发生反应的离子方程是______.
(2)利用该装置设计实验证明醋酸、碳酸、苯酚的酸性强弱,若B为碳酸钠,A与B发生反应的离子方程式是______,能得到的相应结论是______;试管中出现浑浊,依据此现象能否得出相应的结论,请简述理由:______.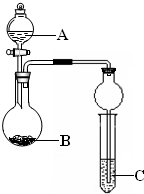
参考答案:(1)NaOH(固体)溶于放热,温度升高,氨气的溶解度变小,氨气溢出,NaOH溶于水,增大OH-的浓度,氨气溶于水是可逆的,NH3+H2O?NH3?H2O?NH4++OH-,氨气溶解度变小,氨气溢出,促使化学平衡逆向移动;氨气从图中左边装置逸到右边装置中,C为AlCl3溶液电离出铝离子和氯离子,NH3+H2O?NH3?H2O?NH4++OH-,铝离子和氢氧根离子反应,生成氢氧化铝白色沉淀,
故答案为:在氨水中有下列平衡:NH3+H2O?NH3?H2O?NH4++OH-,NaOH固体溶于水放热,使得氨气的溶解度减小,同时增大了溶液中的c(OH-),促使化学平衡逆向移动;有白色沉淀产生;Al3++3NH3?H2O=Al(OH)3↓+3NH4+;
(2)醋酸和碳酸都是弱酸,但相同浓度的醋酸和碳酸,醋酸的电离程度比碳酸强,所以醋酸的酸性比碳酸强,根据强酸制弱酸的特点,所以醋酸能和碳酸钠反应生成碳酸,若B为碳酸钠,A为醋酸,醋酸能和碳酸钠反应生成碳酸,但碳酸不稳定能分解生成水和二氧化碳,方程式为CO32-+2CH3COOH→2CH3COO-+H2O+CO2↑,试管中出现浑浊,看到澄清的苯酚钠溶液变浑浊,原因是苯酚钠和水、二氧化碳反应生成苯酚和碳酸氢钠,醋酸具有挥发性,也可能是苯酚钠和乙酸反应生成苯酚,所以不能判断,
故答案为:CO32-+2CH3COOH→2CH3COO-+H2O+CO2↑;醋酸酸性强于碳酸;不能,因为醋酸具有挥发性,挥发出的醋酸也可以和苯酚钠溶液发生反应,生成苯酚;
本题解析:
本题难度:一般
5、填空题 下列有机实验操作或叙述中正确的是?(填写代号)。
A.用银氨溶液检验某病人是否患糖尿病
B.乙酸乙酯中的少量乙酸可用饱和碳酸钠溶液除去
C.蔗糖水解时应用浓硫酸作催化剂
D.在鸡蛋白溶液中滴入浓硝酸,微热会产生黄色物质