微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定温度下,密闭容器中,对可逆反应A(g)+2B(g)?3C(g)的下列叙述中,能说明反应已达到平衡的是( )
A.混合气体的平均相对分子质量不再变化
B.单位时间内消耗a?mol?A,同时消耗3a?molC
C.容器内的压强不再变化
D.混合气体的密度不再变化
参考答案:A.该反应前后气体的计量数不变,无论该反应是否达到平衡状态,混合气体的平均相对分子质量都不变化,所以不能作为判断平衡状态的依据,故A错误;
B.单位时间内,消耗a?mol?A,同时消耗3a?molC,说明正逆反应速率相等,达到平衡状态,故B正确;
C.无论反应是否达到平衡状态,容器内的压强始终不变,所以不能作为判断平衡状态的依据,故C错误;
D.根据质量守恒、容器的体积不变得,无论反应是否达到平衡状态,混合气体的密度始终不变,所以不能作为判断平衡状态的依据,故D错误;
故选B.
本题解析:
本题难度:简单
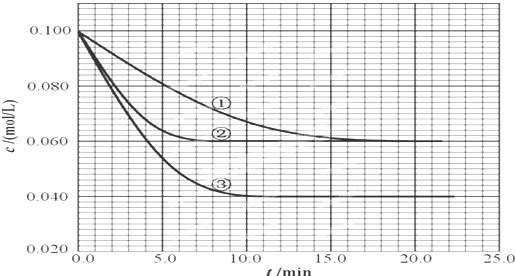
2、简答题 在2.00L的密闭容器中,反应2A(g)?B(g)+C(g)分别在三种不同实验条件下进行,但起始浓度相同,均为c(A)=0.100mol/L、c(B)=0.020mol/L及c(C)=0.020mol/L.反应物A的浓度随时间的变化如下图所示:
请回答下列问题:
(1)以下说法能说明该反应已达到平衡状态的是:______(填序号)
①c(A):c(B):c(C)=2:1:1
②v(A)=2v(B)
③体系的压强不再改变
④A的质量分数不再改变
⑤混合气体的密度不再改变
(2)根据实验③回答:反应开始到4.0min时反应物A的转化率为______,B平均反应速率为______.
(3)与①比较,②和③分别仅改变一种反应条件.所改变的条件是:②______;③______.
(4)实验①条件下该反应的化学平衡常数值是______.若实验①到达平衡后,维持体系温度不变,往容器中再投入0.028molB和0.028molC,求新平衡时体系中A的物质的量浓度.(写出计算过程)
参考答案:(1)①平衡时各物质的物质的量的多少取决于起始量与转化的程度,不能作为判断达到平衡的依据,故错误;
②任何时候,v(A)=2v(B),不能作为判断达到平衡的依据,故错误;
③反应前后气体的化学计量数之和相等,压强不可作为判断的依据,故正确;
④A的质量分数不再改变,能作为判断达到平衡的依据,故正确;
⑤任何时候,混合气体的质量不再发生变化,容器的体积不变,导致混合气体的密度不再变化,所以不能作为判断达到平衡的依据,故错误;
故选:④;
(2)实验②平衡时B的转化率为0.04mol/L0.1mol/L%=40%;
2A(g)?B(g)+C(g)
初始 (mol/L) 0.1 0.02 0.02
转化 (mol/L) 0.04 0.02 0.02
4.0min(mol/L) 0.06 0.04 0.04
则B平均反应速率为0.02mol/L4.0min=0.005mol/(L?min),
故答案为:40%;0.005mol/(L?min);
(3)因催化剂能加快化学反应速度率,缩短达到平衡的时间,化学平衡不移动,所以②为使用催化剂;因升高温度,化学反应速度率加快,化学平衡移动,平衡时A的浓度减小,故答案为:加催化剂;温度升高;
(4)2A(g)?B(g)+C(g)
初始 (mol/L) 0.1 0.02 0.02
转化 (mol/L) 0.04 0.02 0.02
平衡(mol/L) 0.06 0.04 0.04
平衡常数表达式K=C(C)C(B)C2(A)=0.04×0.040.062=49;
往体系中再投入0.028molB和0.028molC后,平衡向左移动,设转化的B的物质的量浓度为x
2A(g)?B(g)+C(g)
旧平衡(mol/L)0.0600.0400.040
新起始(mol/L)0.0600.040+0.0140.040+0.014
转化(mol./L)2xxx
新平衡(mol/L)0.060+2x0.054-x0.054-x
K=(0.054-x)2(0.060+2x)2=49 x=0.006mol/L;
再次达到平衡时A的物质的量浓度:c(A)=(0.060+0.006×2)mol/L=0.072mol/L;
故答案为:49;0.072mol/L.
本题解析:
本题难度:一般
3、填空题 (8分)
(1)已知某温度下,反应2SO2+O2 2SO3,的平衡常数K=19,在该温度下的体积
2SO3,的平衡常数K=19,在该温度下的体积 固定的密闭容器中充
固定的密闭容器中充 入C(SO2)=1mol·L-1,C(O2)="1" mol·L-1,当反应在该温度下SO2转化率
入C(SO2)=1mol·L-1,C(O2)="1" mol·L-1,当反应在该温度下SO2转化率 为80%时,该反应
为80%时,该反应
?(填“是”或“否”)达到化学平衡状态,若未达到,向? (填“正反应”或“逆反应”) 方向进行。
(填“正反应”或“逆反应”) 方向进行。
(2)对于可逆反应:aA(g) +bB(g)  cC(g)+dD(g)?△H = a kJ·mol
cC(g)+dD(g)?△H = a kJ·mol -1;
-1;
若增大压强平衡向正反应方向移动,则a+b?c+d(填“>”或“<”);若升高温度,平衡向正反应方向移动,则a_______0(填“>”或“<”)
参考答案:(1)否?逆反应?(2)>?>
本题解析:略
本题难度:一般
4、选择题 在一定温度下,固定体积为2 L密闭容器中,发生反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0,n(SO2)随时间的变化如表:
2SO3(g) ΔH<0,n(SO2)随时间的变化如表:
时间/min
| 0
| 1
| 2
| 3
| 4
| 5
|
n(SO2)/mol
| 0.20
| 0.16
| 0.13
| 0.11
| 0.08
| 0.08
|
?
则下列说法正确的是( )
A.当v(SO2)=v(SO3)时,说明该反应已达到平衡状态
B.用O2表示0~4 min内该反应的平均速率为0.005 mol/(L·min)
C.若升高温度,则SO2的反应速率会变大,平衡常数K值会增大
D.平衡时再通入O2,平衡右移,O2转化率减小,SO2转化率增大
参考答案:D
本题解析:对v(SO2)、v(SO3)未指明反应速率的方向,A项错误;0~4 min内O2的平均速率为:v(O2)=v(SO2)/2=(0.20-0.08) mol/(2 L×4 min)×1/2=0.0075 mol/(L·min),B项错误;该反应是放热反应,升高温度,平衡逆向移动,化学平衡常数减小,C项错误;增大氧气的浓度,平衡向右移动,可提高SO2的转化率,但是O2转化率降低,D项正确。
本题难度:一般
5、填空题 氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2(s)+6C(s)+ 2N2(g)  ?Si3N4(s)? + 6CO(g)
?Si3N4(s)? + 6CO(g)
(1)该反应的氧化剂是?,2molN2参加反应转移电子数为?;
(2)该反应的平衡常数表达式为K= ? ;
(3)若CO的生成速率为v(CO)=18mol·L-1·min-1,则N2的消耗速率为v(N2)=?
(4)达到平衡后,改变某一外界条件(不改变N2、CO的量),反应速率v与时间t的关系如图。图中t4时引起平衡移动的条件可能是?;图中表示平衡混合物中CO的含量最高的一段时间是?。

(5)若该反应的平衡常数为 K=729,则在同温度下1L密闭容器中,足量的SiO2和C与2mol N2充分反应,则N2的转化率是?(提示:272 = 729)
参考答案:(1)氮气 (1分) ?12NA? (1分)(2)K=[c(CO)]6/[c(N2)]2? (2分)(3)6 mol?L-1?min-1 (1分) ?(4)升高温度或增大压强(2分) ?t3~t4(2分) ?(5)50%(2分)
本题解析:(1)反应中N元素的化合价降低,有0价降为-3价,则氧化剂为氮气,氧化剂对应的生成物为还原产物,应为氮化硅,故答案为:氮气;氮化硅;(2)平衡常数等于气体生成物的浓度幂之积除以气体反应物的浓度幂之积,则K=[c(CO)]6/[c(N2)]2(3)反应放热,△H<0,升高温度平衡移动逆反应方向移动,平衡常数减小,速率之比等于化学计量数之比,则v(N2)=1/3×v(CO)=1/3×18mol?L-1?min?1="6" mol?L-1?min?1(4) t4时正逆反应速率都较原平衡时的速率大,可升高温度或增大压强,在t4时反应向逆反应方向移动,则t3~t4时平衡混合物中CO的含量最高,故答案为:升高温度或增大压强,t3~t4;
(5)设反应的N2的物质的量为x,
3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
起始:? 2mol?0
转化:? x?3x
平衡:? 2-x?3x
则平衡时N2的浓度为(2-x)mol/L,CO的浓度为3x mol/L,则有:(3x)6/(2-x)2=729,解之得x=1,则N2的转化率是50%。
本题难度:困难