微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列说法正确的是 ( )
①活化分子间的碰撞一定能发生化学反应
②普通分子有时也能发生有效碰撞
③升高温度会加快反应速率,原因是增加了活化分子的有效碰撞次数
④增大反应物浓度会加快反应速率的原因是单位体积内有效碰撞的次数增多
⑤使用催化剂能提高反应速率,原因是提高了分子的能量,使有效碰撞频率增大
⑥化学反应实质是活化分子有合适取向时的有效碰撞
A.③④⑥
B.①②⑤
C.③④⑤⑥
D.②③④
参考答案:A
本题解析:活化分子间的碰撞不一定能发生化学反应,①错误;只有活化分子才能发生有效碰撞,②错误;使用催化剂能提高反应速率,原因是催化剂可以降低反应的活化能,使有效碰撞频率增大,⑤错误,其余选项都是正确的,答案选A。
点评:该题是中等难度试题的考查,侧重考查学生对活化分子、有效碰撞等有关概念的熟悉了解程度,以及灵活运用基础知识解决实际问题的能力,有利于调动学生的学习兴趣和学习积极性。
本题难度:简单
2、填空题 氨气是重要化工产品之一。传统的工业合成氨技术的反应原理是:
N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量浓度变化如图所示,回答下列问题:
2NH3(g) ΔH=-92.4 kJ/mol。在500 ℃、20 MPa时,将N2、H2置于一个固定容积的密闭容器中发生反应,反应过程中各种物质的量浓度变化如图所示,回答下列问题:
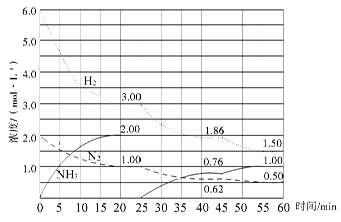
(1)计算反应在第一次平衡时的平衡常数K=?。(保留二位小数)
(2)产物NH3在5~10 min、25~30min和45~50 min时平均反应速率(平均反应速率分别以v1、v2、v3表示)从大到小排列次序为?。
(3)H2在三次平衡阶段的平衡转化率分别以α1、α2、α3表示,其中最小的是?。
(4)由第一次平衡到第二次平衡,平衡移动的方向是____________,采取的措施是____________
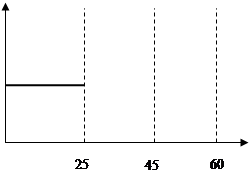
(5)请在下图中用实线表示25~60min 各阶段化学平衡常数K的变化图像。
 ?
?
参考答案:
(1)0.15(2分)? (2) v1>v2>v3?(2分)?(3) α3?(2分)?
(4)正反应方向移动(1分)?移走生成物NH3(1分)
(5)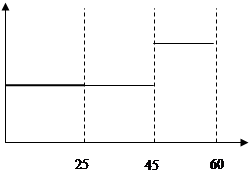 (2分)
(2分)
本题解析:⑴ ;⑵化学反应速率是用单位时间内反应物或生成物浓度的变化量来表示的,5~10 min、25~30min和45~50 min,这三段时间间隔是相同的,只要比较他们的浓度变化就可以,从图上可以看出,这三段时间变化的大小分别为:v1>v2>v3;⑶转化率就是反应掉的物质的量或者浓度与原来的物质的量或者浓度的比,从图中数据变化可知变化最小的是α3;⑷从图中可以看出,由第一次平衡到第二次平衡,反应物的浓度减小,肯定是正向移动,但是氨的浓度从零开始,表明采取的措施是移走生成物NH3。⑸25~45min,温度没有变化,而平衡常数是只随温度的改变而改变的。因此在这一范围内,K值不变;45~60min,平衡继续正向移动,在45分钟这个时间,各物质的浓度没有发生变化,因些平来源:91考试网 91EXAm.org衡移动与浓度和压强变化无关,只能是降低了温度而引起的平衡移动。因为温度发生了变化,因此平衡常数也发生还应的改变,使得K值增大。
;⑵化学反应速率是用单位时间内反应物或生成物浓度的变化量来表示的,5~10 min、25~30min和45~50 min,这三段时间间隔是相同的,只要比较他们的浓度变化就可以,从图上可以看出,这三段时间变化的大小分别为:v1>v2>v3;⑶转化率就是反应掉的物质的量或者浓度与原来的物质的量或者浓度的比,从图中数据变化可知变化最小的是α3;⑷从图中可以看出,由第一次平衡到第二次平衡,反应物的浓度减小,肯定是正向移动,但是氨的浓度从零开始,表明采取的措施是移走生成物NH3。⑸25~45min,温度没有变化,而平衡常数是只随温度的改变而改变的。因此在这一范围内,K值不变;45~60min,平衡继续正向移动,在45分钟这个时间,各物质的浓度没有发生变化,因些平来源:91考试网 91EXAm.org衡移动与浓度和压强变化无关,只能是降低了温度而引起的平衡移动。因为温度发生了变化,因此平衡常数也发生还应的改变,使得K值增大。
本题难度:困难
3、选择题 一定温度下,下列叙述不能作为可逆反应A(g)+3B(g)?2C(g)达到平衡标志的是( )
①C的生成速率与C的消耗速率相等?
②单位时间内生成a?mol?A,同时生成3a?mol?B
③A、B、C的浓度不再变化?
④C的物质的量不再变化
⑤混合气体的总压强不再变化?
⑥混合气体的总物质的量不再变化
⑦单位时间消耗a?mol?A,同时生成3a?mol?B?
⑧A、B、C的分子数之比为1:3:2.
A.②⑧
B.⑦④
C.①③
D.⑤⑥
参考答案:①C的生成速率与C的消耗速率相等时,该反应达到平衡状态,故正确;?
②无论反应是否达到平衡状态,单位时间内生成a?mol?A同时生成3a?molB,所以不能说明该反应达到平衡状态,故错误;
③A、B、C的浓度不再变化,可说明达到平衡状态,故正确;?
④C的物质的量不再变化,可说明达到平衡状态,故正确;
⑤由于反应前后气体的体积不等,恒容容器中,混合气体的总压强不再变化,可说明达到平衡状态,故正确;?
⑥混合气体的总物质的量不再变化,可说明达到平衡状态,故正确;
⑦单位时间消耗amolA,同时生成3amolB,说明正逆反应速率相等,则达到平衡状态,故正确;?
⑧A、B、C的分子数之比为1:3:2,不能用以判断是否达到平衡状态,与起始配料比以及反应的转化程度有关,故错误;
故选A.
本题解析:
本题难度:简单
4、填空题 碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?

?WI2(g)
为模拟上述反应,在实验室中准确称取0.508g碘、0.736g金属钨放置于50.0mL密闭容器中,并加热使其反应.如图是混合气体中的WI2蒸气的物质的量随时间变化关系的图象[n(WI2)~t],其中曲线Ⅰ(0~t2时间段)的反应温度为450℃,曲线Ⅱ(从t2时刻开始)的反应温度为530℃.请回答下列问题:
(1)该反应的化学平衡常数表达式为:K=______
(2)该反应是______(填“放热”或“吸热”)反应,判断依据是:______.
(3)反应从开始到t1(t1=3min)时间内的平均速率:u(I2)=______.
(4)能够说明上述反应已经达到平衡状态的有______.
a.I2与WI2的浓度相等
b.单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等
c.容器内混合气体的密度不再改变
d.容器内气体压强不发生变化
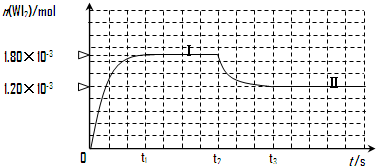
参考答案:(1)因平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以K=C(WI2)C(I2),故答案为:C(WI2)C(I2);
(2)化学平衡常数的大小只与温度有关,升高温度,平衡向吸热的方向移动,由表可知:升高温度,WI2的物质的量减少,说明化学平衡逆向移动,因此正反应方向放热,故答案为:放热;温度升高,n(WI2)减小,平衡向左移动,所以是放热反应;
(3)从反应开始到t1时间内,结合图象,生成WI2(g)的物质的量为1.8×10-3mol,所以碘单质的物质的量减少1.8×10-3mol,根据公式v=△c?△t=△nV△t=1.8×10-3mol0.05L?3min=1.20×10-2?mol?L-1?min-1,故答案为:1.20×10-2?mol?L-1?min-1;
(4)A、达到平衡状态时,各物质的浓度不变,不一定相等,故A错误;
B、单位时间内,金属钨消耗的物质的量与单质碘生成的物质的量相等,说明v逆=v正,故B正确;
C、由于反应物中有气体,只有在平衡状态,密度不变,故C正确;
D、因前后气体分子数相等,则无论是否达到平衡状态,压强不变,故D错误;
故选:b、c.
本题解析:
本题难度:一般
5、简答题 一定温度下在体积为5L的密闭容器中发生可逆反应.
(Ⅰ)若某可逆反应的化学平衡常数表达式为:K=
(1)写出该反应的化学方程式:______;
(2)能判断该反应一定达到化学平衡状态的依据是______(填选项编号).
A.容器中气体的平均相对分子质量不随时间而变化
B.υ正(H2O)=υ逆(H2)
C.容器中气体的密度不随时间而变化
D.容器中总的物质的量不随时间而变化
E.消耗n?mol?H2的同时消耗n?mol?CO
(Ⅱ)若该密闭容器中加入的是2molFe(s)与1mol?H2O(g),t1秒时,H2的物质的量为0.20mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.35mol.
(1)t1~t2这段时间内的化学反应速率v(H2)=______.
(2)若继续加入2mol?Fe(s),则平衡______移动(填“向正反应方向”、“向逆反应方向”或“不”),继续通入1mol?H2O(g)?再次达到平衡后,H2的物质的量为______mol.
(3)该反应的逆反应速率随时间变化的关系如右图.t1时改变了某种条件,改变的条件可能是______、______.(填写2项)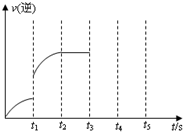
参考答案:(Ⅰ)(1)根据平衡常数的定义,生成物浓度的幂之积与反应物浓度的幂之积之比为平衡常数.
故答案为:C(s)+H2O(g)?
CO(g)+H2?(g)?
(2)A、反应前后气体的体积不相同,容器中气体的平均相对分子质量不断减小,当不随时间变化即达到平衡,故A正确;
B、υ正(H2O)=υ逆(H2)时,反应达到平衡,故B正确;
C、反应开始时,容器中气体的密度不断减小,当不随时间变化时,反应达到平衡,故C正确;
D、容器中总的物质的量自始至终不随时间而变化,故D错误;
E、消耗n?mol?H2的同时消耗n?mol?CO,反应都代表逆反应,故E错误;
故选A、B、C;
(Ⅱ)(1)根据反应速率的计算公式,v(H2)=0.03(t2-t1)?mol?L-1?s-1.故答案为:0.03(t2-t1)?mol?L-1?s-1
(2)加入Fe后,Fe是固体,平衡不移动;再加入1molH2O(g)?再次达到平衡够,H2的物质的量为原来的2倍.
故答案为:不; 0.7?
(3)如右图t1时刻,反应速率突然增大,可能使用了催化剂等.
故答案为:使用了催化剂、升高了温度、增大了H2的浓度.
本题解析:
本题难度:一般