微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在一定温度下,饱和氯水中存在平衡:Cl2+H2O?H++Cl-+HClO.下列说法中,正确的是( )
A.光照一段时间后,
增大
B.加入碳酸钙粉末后,溶液的pH增大
C.稀释溶液,由水电离的c(H+)减小
D.加入NaOH固体,一定有c(Na+)>c(Cl-)>c(H+)>c(ClO-)
参考答案:A、光照HClO分解生成HCl,溶液中c(ClO-)降低,c(H+)增大,C(ClO-)C(H+)减小,故A错误;
B、碳酸钙与盐酸反应,虽然平衡向正反应移动,但氢离子浓度不达到原来的浓度,溶液中c(H+)减小,溶液的pH增大,故B正确;
C、稀释溶液,溶液中c(H+)减小,c(OH-)浓度增大,溶液中OH-的浓度等于水电离的H+的浓度,水电离的c(H+)增大,故C错误;
D、加入过量的氢氧化钠,溶液中c(ClO-)远远大于c(H+),故D错误;
故选B.
本题解析:
本题难度:简单
2、选择题 在一定温度不同压强(P1<P2)下,可逆反应2X(g)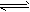 2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(W)与反应时间(t)的关系有以下图示,正确的是
2Y(g) + Z(g)中,生成物Z在反应混合物中的体积分数(W)与反应时间(t)的关系有以下图示,正确的是
[? ]
A.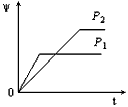
B.
C.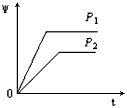
D.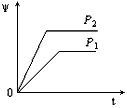
参考答案:B
本题解析:
本题难度:一般
3、选择题 25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn),发生反应:Sn(s)+Pb2+(aq)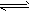 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如图所示。
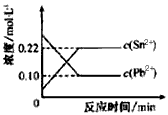
下列判断正确的是
[? ]
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应△H>0
D.25℃时,该反应的平衡常数K=2.2
参考答案:D
本题解析:
本题难度:一般
4、选择题 对于可逆反应:2SO2(g)+O2(g)?2SO3(g)△H<0,降低温度产生的影响为( )
A.v正增大,v逆减小
B.v正减小,v逆增大
C.v正和v逆同程度的减小
D.v正和v逆不同等程度的减小
参考答案:A、降低温度,正逆化学反应速率都减小,即v正减小,v逆 减小,故A错误;
B、降低温度,正逆化学反应速率都减小,即v正减小,v逆 减小,故B错误;
C、降低温度,化学平衡向着放热方向进行,即向着正方向进行,正反应速率大于逆反应速率,即正反应速率增加的程度大,故C错误;
D、降低温度,化学平衡向着放热方向进行,即向着正方向进行,但是增加程度不一样,正逆反应速率不相等,正反应速率大于逆反应速率,正反应速率减小的少,故D正确;
故选:D.
本题解析:
本题难度:一般
5、填空题 研究NO2、SO2、CO等大气污染物气体的处理具有重要意义。
(1)已知:2SO2(g)+O2(g) 2SO3(g);△H= -Q1KJ·mol-1
2SO3(g);△H= -Q1KJ·mol-1
? 2NO(g)+O2(g)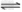 2NO2(g);△H= -Q2KJ·mol-1
2NO2(g);△H= -Q2KJ·mol-1
则反应NO2(g)+SO2(g) SO3(g)+NO(g);△H= ________KJ·mol-1
SO3(g)+NO(g);△H= ________KJ·mol-1
(2)一定条件下,将NO2与SO2以体积比1︰2置于密闭容器中发生上述反应,当平衡时NO2与NO体积比为1︰3,则平衡常数K=________ 。
(3)CO可用于合成甲醇,反应方程式为:CO(g)+2H2(g)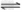 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示,则该反应△H= _____0 (填“>” 或“<” )。实际生产条件下控制在250℃、1.3×104kPa左右,选择此条件下的理由是__________ 。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如下图所示,则该反应△H= _____0 (填“>” 或“<” )。实际生产条件下控制在250℃、1.3×104kPa左右,选择此条件下的理由是__________ 。
参考答案:(1)-(Q1-Q2)/2或(Q2-Q1)/2
(2)1.8
(3)<;该反应是放热反应,降低温度,有利于甲醇合成,在250℃、1.3×104kPa下,CO的转化率已经很高,增加压强CO的转化率提高不大,而生产成本却会显著增加(或经济效益不好)
本题解析:
本题难度:一般