微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 高炉炼铁中发生的基本反应之一如下:FeO(s)+CO(g) Fe(s)+CO2(g)△H>0。
Fe(s)+CO2(g)△H>0。
(1)其平衡常数可表示为______________, 温度降低,化学平衡移动后达到新的平衡,高炉内CO2和
CO的体积比值____,平衡常数K值_____(本小题空格均备选:增大、减小或不变)
(2)已知1100℃时K=0.263。1100℃时测得高炉中c(CO2)=0.025 mol·L-1,c(CO)=0.1mol·L-1,在这种情况下,该反应是否处于化学平衡状态____(选填“是”或“否”),此时,化学反应速率是
υ正___υ逆(选填“大于”、“小于”或“等于”),其原因是___________。
参考答案:(1)c(CO2)/c(CO);减小;减 小
(2)否;>;Q<K,平衡正向移动
本题解析:
本题难度:一般
2、填空题 高炉炼铁中发生的基本反应之一如下:FeO(s) +CO(g) Fe(s)+CO2(g)-Q 其平衡常数可表示为K=
Fe(s)+CO2(g)-Q 其平衡常数可表示为K=
c(CO2)/c(CO),已知1100℃时 K=0. 263.且化学平衡常数只与温度有关,不随浓度和压强的变化而变化。
(1)温度升高,化学平衡移动后达到新的平衡,高炉内CO2 和CO的体积比值____,平衡常数K值___。(填 “增大”“减小”或“不变”)
(2)1100℃时测得高炉中c(CO2)=0.025mol/L,c(CO)= 0.1 mol/L.在这种情况下,该反应是否处于化学平衡状态 _____(填“是”或“否”)。此时,化学反应速率是v正_____v逆(填“大于”“小于”或“等于”),其原因是_____________。
参考答案:(1)增大 ;增大
(2)否 ;大于 ;此时c(CO2)/c(CO)< 0.263,因温度不变,K值不变,为增大c(CO2)/c(CO)比值,需 v正>v逆
本题解析:
本题难度:一般
3、填空题 在恒温恒容的条件下,发生H2(g)+I2(g)?2HI(g),已知①②③的平衡状态中,HI%相同,填写表中的空白:
| 编号 | ?起始状态(mol) | ?平衡时HI的物质的量(mol)
?H2
?I2
?HI
?已知
?1
?2
?0
?a
?①
?2
?4
?0
?
______
?②
?
______
?
______
?1
?0.5a
?③
?m
?n(n≥2m)
?
______
?
______
参考答案:恒温恒容下,发生H2(g)+I2(g)?2HI(g),该反应前后气体的物质的量不变,已知及①②③的平衡状态中,HI%相同,则为等效平衡,已知中平衡状态n(HI)=amol,故HI%=amol1mol+3mol=a3
①反应前后气体的物质的量不变,故平衡时n(HI)=(2mol+4mol)×a3=2amol;
中n(H2):n(I2)=2mol:4mol=1:2,与已知为等效平衡,
②平衡时HI的物质的量为0.5amol,故混合气体的总的物质的量为0.5amola3=1.5mol,1molHI转化到左边可以得到0.5molH2、0.5molI2,令H2、I2分别为xmol、ymol,则:x+y+1=1.5,且(x+0.5):(y+0.5)=1:2,联立解得x=0,y=0.5;
③令HI为amol,则转化到左边可以得到0.5amolH2、0.5amolI2,故(m+0.5a):(n+0.5a)=1:2,解得a=2n-4m,故混合气体的总的物质的量为mmol+nmol+(2n-4m)mol=(3n-3m)mol,故平衡时n(HI)=(3n-3m)mol×a3=(n-m)amol;
故答案为:编号?起始状态(mol)?平衡时HI的物质的量(mol)?H2?I2?HI?已知?1?2?0?a?①?2?4?0?
2a?②?
0?
0.5?1?0.5a?③?m?n(n≥2m)?
(2n-4m)?
(n-m)a.
本题解析:
本题难度:一般
4、选择题 反应2A(g)?2B(g)+C(g);△H>0,达平衡后,要使v(正)降低、c(A)增大,应采取的措施是( )
A.降温
B.加催化剂
C.升温
D.加压
参考答案:A.降低温度,正逆反应速率都减小,平衡向逆反应方向移动,c(A)增大,故A正确;
B.加入催化剂,正逆反应速率均加快,化学平衡不会发生移动,故B错误;
C.升高温度,化学反应速率加快,平衡向正反应方向移动,c(A)减小,故C错误;
D.增大压强,平衡向逆反应方向移动,正逆反应速率都增大,故D错误;
故选A.
本题解析:
本题难度:一般
5、填空题 红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g).反应过程和能量关系如图所示(图中的ΔH表示生成1?mol产物的数据).
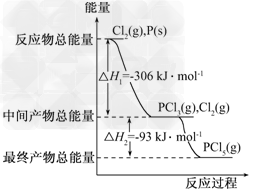
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是 ___________________________________;
(2)PCl5分解成PCl3和Cl2的热化学方程式是 __________________________________;上述分解反应是一个可逆反应.温度T1时,在密闭容器中加入0.80?mol?PCl5,反应达平衡时PCl5还剩0.60?mol,其分解率α1等于________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2________α1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5.原因是__________________________;
(4)P和Cl2分两步反应生成1?mol?PCl5的ΔH3=________,P和Cl2一起反应生成1?mol?PCl5的ΔH4________ΔH3(填“大于”、“小于”或“等于”).
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是_____________________.
参考答案:(1)3/2Cl2(g)+P(s)===PCl3(g) ΔH=-306?kJ/mol
(2)PCl5(g)===PCl3(g)+Cl2(g) ΔH=+93?kJ/mol;25%;大于
(3)两步反应均为放热反应,降温有利于提高产率,防止产物分解
(4)-399?kJ/mol;等于
(5)PCl5+4H2O===H3PO4+5HCl
本题解析:
本题难度:一般
|