|
高考化学知识点总结《磷及其化合物》考点强化练习(2017年押题版)(十)
2017-08-22 14:39:21
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 在给定条件下,下列加点的物质在化学反应中能被完全消耗的是?(?)
A.向100 mL 3 moI·L—1的硝酸中加入5.6g铁
B.标准状况下,将1g铝片投入20 mL 18.4mol·L—1的硫酸中
C.用50mL 8 mol·L—1浓盐酸与10g二氢化锰共热制取氯气
D.在5×l07Pa、500℃和铁触媒催化的条件下,用氢气和氢气合成氨
参考答案:A
本题解析:略
本题难度:简单
2、填空题 (7分)按图所表示的装置进行实验:
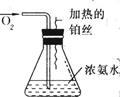
(1)实验开始一段时间后,可观察到锥形瓶口上方有白烟生成,请将可能观察到的其他现象补齐_________.有关化学方程式为________________
(2)由于气温的原因,上述实验一段时间后现象不太明显,应该向锥形瓶内加入下列哪种物质才能看到明显的现象________(填字母)。
A.NaOH固体
B.生石灰
C.浓H2SO4
D.NH4Cl固体
| (3)经过对比试验证明。在其他条件相同时,用空气代替氧气的实验效果较差,主要原因是 __________________
参考答案:(1)在锥形瓶口附近有红棕色气体生成,铂丝保持红热;4NH3+5O2=4NO+6H2O,2NO+O2=2NO2,3NO2+H2O=2HNO3+NO,NH3+HNO3=NH4NO3(2)A B D(3)空气中含氧的体积分数低。
本题解析:根据NH3能被催化氧化为NO,NO与O2反应生成NO2,进而生成 HNO3、NH4NO3的性质不难判断.锥形瓶上方的白烟为NH4NO3,依次可推知锥形瓶内的现象及反应的化学方程式.为了使气体NH3能从浓氨水中逸出,由NH3+H2O?NH3·H2O?NH4++OH-知,可向其中加入强碱、铵盐或加热,但由于浓H2SO4与氨水反应消耗氨,故加浓H2SO4不能放出NH3.空气中含氧的体积分数低,不利于氨的氧化;氮气不能发生反应,但其挥发带走热量,使反应物温度降低.
本题难度:简单
3、填空题 在浓硝酸中放入铜片:
(1)开始反应的化学方程式为_________________。
(2)若铜有剩余,则反应将要结束时的反应化学方程式是______________________。
(3)待反应停止后,再加入少量25%的稀硫酸,这时铜片上又有气泡产生,其原因和离子方程式是_____?。
?。
(4)若将12.8 g铜跟一定量的浓硝酸反应,铜消耗完时,共产生气体5.6 L(标准状况),则所消耗的硝酸的物质的量是________,
参考答案:(1)Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑
(2)3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑
(3)H2SO4提供H+,NO3-继续与Cu发生反应:3Cu+8H++2NO3- ===3Cu2++2NO↑+4H2O
(4)0.65 mol
本题解析:浓硝酸具有氧化性,可以氧化铜,方程式为Cu+4HNO3(浓)=Cu(NO3)2+2H2O+2NO2↑。随着反应的进行,硝酸的浓度会逐渐变稀,所以此时发生的反应是3Cu+8HNO3(稀)=3Cu(NO3)2+4H2O+2NO↑。反应结束后在溶液中有硝酸铜,当加入少量25%的稀硫酸,溶液就会电离出大量当氢离子,从而是NO3-具有氯氧化性,可继续氧化铜。离子方程式为3Cu+8H++2NO3- ===3Cu2++2NO↑+4H2O。5.6 L气体是NO和NO2的混合气体,其物质的量是0.25mol,所以被还原的硝酸是0.25mol。铜是0.2mol,生成硝酸铜也是0.2mol,因此没有被还原的硝酸是0.4mol,所以参加反应的硝酸一共是0.65mol。
本题难度:一般
4、判断题 在50 mL b mol·L-1 AlCl3溶液中加入50 mL a mol·L-1的NaOH溶液。试问:
(1)当a≤3b时生成Al(OH)3沉淀的物质的量是_______________.
(2)当a、b满足什么条件时,无沉淀生成?
(3)当a、b满足什么条件时,先有沉淀生成后沉淀部分溶解?
参考答案:(1)  a mol?(2)a≥4b?(3)3b<a<4b a mol?(2)a≥4b?(3)3b<a<4b
现在,我们已经学过的常见的两步反应有:
① SO2+NaOH=NaHSO3;SO2+2NaOH=Na2SO3+H2O
② CO2+NaOH=NaHCO3;CO2+2NaOH=Na2CO3+H2O
③ H2S+NaOH=NaHS;H2S+2NaOH=Na2S+H2O
④ 2H2S+O2 ?2S+2H2O;2H2S+3O2 ?2S+2H2O;2H2S+3O2 ?2SO2+2H2O ?2SO2+2H2O
⑤ C+O2 CO2;2C+O2 CO2;2C+O2 2CO 2CO
⑥FeO+C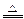 Fe+CO↑;2FeO+C Fe+CO↑;2FeO+C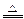 2Fe+CO2↑ 2Fe+CO2↑
⑦CuO+C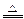 Cu+CO↑;2CuO+C Cu+CO↑;2CuO+C 2Cu+CO2↑ 2Cu+CO2↑
⑧ 2[Al(OH)4]-+CO2=2Al(OH)3↓+CO32-+H2O;[Al(OH)4]-+CO2=Al(OH)3↓+HCO3-
⑨ AlCl3+3NaOH=Al(OH)3↓+3NaCl;AlCl3+4NaOH=NaAlO2+3NaCl+2H2O
⑩ [Al(OH)4]-+H+=Al(OH)3↓+H2O;[Al(OH)4]-+4 H+=Al3++4H2O
本题解析:AlCl3与NaOH间存在下列两种反应:
①AlCl3+3NaOH=Al(OH)3↓+3NaCl
②AlCl3+4NaOH=Na[Al(OH)4]+3NaCl
(1)a≤3b时,只发生反应①,NaOH不足或恰好完全反应。
n[Al(OH)3]=1/3n(NaOH)=1/3×0.050 L×a mol·L-1= a mol a mol
(2)当只有②反应发生时,无沉淀生成,此时AlCl3不足或恰好完全反应。
n(NaOH)≥4n(AlCl3)
50 mL×a mol·L-1≥4×50 mL×b mol·L-1
a≥4b
(3)当①②两反应都发生时,先有沉淀生成,后沉淀部分溶解。此时,a、b关系介于以上两种情况之间。即:3b<a<4b
本题难度:简单
5、选择题 试管中盛有少量白色固体,可能是铵盐,检验的办法是(?)
A.加水,将湿润的红色石蕊试纸放在试管口
B.加NaOH溶液,加热,滴入紫色石蕊试剂
C.加NaOH溶液,加热,滴入酚酞试剂
D.加NaOH溶液,加热,将湿润的红色石蕊试纸放在试管口
参考答案:D
本题解析:检验铵根离子的方法是向试样中加入氢氧化钠溶液,加热,产生的气体使湿润的红色石蕊试纸变蓝。
点评:氨气是碱性气体,能使湿润的红色石蕊试纸变蓝。
本题难度:一般
|