微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、实验题 某研究性学习小组设计实验方案来研究稀硝酸与铜反应生成NO。

(1)补充完成下列实验步骤:
①__________________________________________;
②打开活塞A,往U型管右侧漏斗中注入稀硝酸,一直注到稀HNO3接触到A处橡皮塞为止;
③关闭活塞A,观察实验现象。
(2)记录描述观察到的实验现象:
可观察到的现象有:U型管左侧铜丝逐渐溶解,有_____色气体产生,溶液呈______色,随着反应不断进行,最后反应自行停止,该过程反应的离子方程式为________________________________。
(3)试管内装有NO,倒置于水槽中,当向试管内通入21mLO2时,最后试管中的液面仍在原来的位置,则原试管中NO的体积为_________mL。
(4)0.1L稀硝酸和稀硫酸的混合液,其物质的量浓度分别为0.1mol/L和0.4mol/L。若向该混合液中加入足量的铜粉,则最多能溶解铜粉的质量_______g。若要使溶液中的Cu2+全部转化为Cu(OH)2沉淀,应加入2 mol·L-1的氢氧化钠溶液?_mL。
参考答案:(1)检查装置气密性(2分)
(2)无?,蓝??(各1分)?3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O(2分)
(3)12mL(2分)
(4)0.96g(2分)40mL(2分)
本题解析:向装有NO的试管中通入O2,发生如下反应4NO+3O2+2H2O=4HNO3,假设NO的体积为x则消耗的O2为3x/4,4:3=x:3x/4解得x=12;混合酸中加入足量铜粉发生如下反应3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,溶液中H+的总量为0.09mol、NO3-的物质的量为0.01,假设Cu的物质的量为x,根据方程式则3:2=x:0.01,解得x=0.015,计算铜的质量为0.96g。且消耗的H+的物质的量为0.04mol,当加入氢氧化钠时先中和掉剩余的H+,需要氢氧化钠的量为0.05mol,将Cu2+全部转化为沉淀,需要氢氧化钠的量为0.03mol,则总共为0.08mol,据体积V=n/C,解得V="0.04L."
本题难度:一般
2、选择题 起固定氮作用的化学反应是(? )
A.N2与H2在一定条件下反应生成NH3
B.NO遇O2转化为NO2
C.硝酸工厂用NH3氧化制NO
D.由NH3制碳酸氢铵和硫酸铵
参考答案:A
本题解析:固氮是指氮由游离态转化为化合态,故答案选A。
本题难度:简单
3、选择题 某稀硝酸与铜反应缓慢,为了提高该化学反应的反应速率,下列措施中不可取的是(?)
A.微热
B.加入少量烧碱
C.滴入少量浓硫酸
D.滴入少量浓硝酸
参考答案:B
本题解析:B项中加入烧碱后,发生中和反应,减小了溶液中的c(H+),使反应速率减小。
本题难度:简单
4、实验题 如图1所示是实验室中制取气体的一种简易装置。
(1)请简述检验它的气密性的方法?。
(2)利用如图1所示装置制取气体时,可适用的反应条件和反应物状态为________________________。
某同学设计如图2所示装置,用粗铁粒与16.9%稀硝酸反应制取NO气体并探究产物中铁的价态。请回答有关问题。
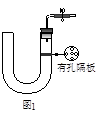
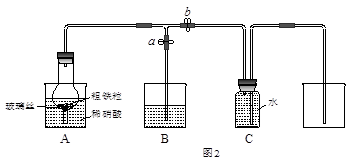
(3)已知16.9%稀硝酸的密度为1.10g·cm-3,则其物质的量浓度为____________(计算结果保留两位小数)。若用63%的硝酸配制16.9%稀硝酸500mL,所需的玻璃仪器有量筒、玻璃棒、烧杯、?。
(4)实验开始时,先打开止水夹a、关闭止水夹b时,A装置的干燥管中观察到的现象是?。B装置烧杯中液体的作用是_________________________。当A装置中气体几乎无色时,打开止水夹b,关闭止水夹a,可用C装置收集NO气体。
(5)现有仪器和药品:试管和胶头滴管,0.1mol·L-1KSCN溶液、0.2mol·L-1酸性KMnO4溶液、0.1mol·L-1KI溶液、氯水等。请你设计一个简单实验,探究A装置烧杯里完全反应后含铁可能的价态,填写下列实验报告:
实验步骤
| 操作
| 现象与结论
|
第一步
| 取少量液体装于试管,向试管中滴入几滴KSCN溶液。
| ?
|
第二步
| ?
| 若溶液紫色褪去,则说明含有Fe2+;
若无明显变化,则说明不含Fe2+。
|
?
参考答案:(1)关闭止水夹,从左管处加水,使U形管两端形成液面差,一段时间后,液面差没有变化,说明气密性良好(没有关闭止水夹不得分)(2分)
(2)不溶于水的块状固体,不需要加热(2分)
(3)2.95mol·L-1(2分,没单位不得分)?
500mL容量瓶、胶头滴管(2分,各1分,其中500mL容量瓶只答容量瓶不给分)
(4)铁粒逐渐溶解,有气泡产生,干燥管上方出现红棕色气体(2分,只要答出红棕色气体即给2分)?吸收二氧化氮(2分)
(5)若溶液呈血红色,则说明含Fe3+,若不显血红色,证明没有Fe3+(1分)
取少量液体装于试管,向试管中滴入几滴酸性KMnO4溶液(1分)
本题解析:(1)利用气体压强来检验装置的气密性,具体操作:关闭止水夹,从左管处加水,使U形管两端形成液面差,一段时间后,液面差没有变化,说明气密性良好
(2)图1相当于简易启普发生器装置,可适用的反应条件和反应物状态为不溶于水的块状固体,不需要加热
(3)利用溶液中溶质质量分数与物质的量浓度的换算关系,得稀硝酸的物质的量浓度为1000ml·L-1×1.10 g·cm-3×16.9%/63g·mol-1=2.95mol·L-1,配制500ml的溶液还需500mL容量瓶、胶头滴管
(4)装置中存在空气,所以实验开始时看到A中铁粒逐渐溶解,有气泡产生,干燥管上方出现红棕色气体,B装置中液体的作用是除去二氧化氮气体
(5)铁元素的价态一般为+2、+3,加入KSCN溶液,若有溶液呈血红色,则说明含Fe3+,若不显血红色,证明没有Fe3+;紫色溶液为高锰酸钾溶液,所以第二步中操作为取少量液体装于试管,向试管中滴入几滴酸性KMnO4溶液
本题难度:困难
5、简答题
图①-?分别代表有关反应中的一种物质,请填下以下空白。
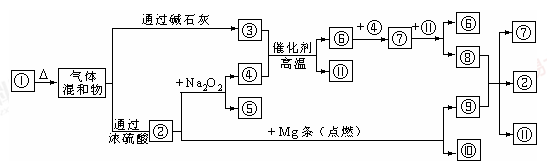
(1)①、④的化学式分别是______、______。
(2)用电子式表示②的形成过程为?;
(3)⑧与⑨反应的化学方程式是______;检验③的存在的方法是?。
(4)Mg也可以与⑧的稀溶液反应生成⑥,写出反应的离子方程式?。
参考答案:(1)(NH4)2CO3或NH4HCO3? O2
(2)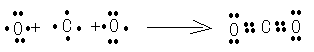
(3)C+4HNO3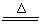 4NO2↑+CO2↑+2H2O,用湿润的红色石蕊试纸放在试管口,若试纸变成蓝色,则生成氨气;
4NO2↑+CO2↑+2H2O,用湿润的红色石蕊试纸放在试管口,若试纸变成蓝色,则生成氨气;
(4)3Mg+8H++2NO3-=3Mg2++2NO↑+4H2O
本题解析:由②+Mg→⑨+⑩,想到中学化学的典型反应CO2+2Mg=C+2MgO知②为CO2为突破口,由②+Na2O2→④+⑤,且②为CO2,推断知④、⑤为Na2CO3和O2,由③+④ ⑥+
⑥+ ?推断知④为O2则⑤为Na2CO3,③为NH3,其余依次推出,①为(NH4)2CO3或NH4HCO3,⑥为NO,⑦为NO2,⑧为HNO3,⑨为C,⑩为MgO,⑩为H2O。
?推断知④为O2则⑤为Na2CO3,③为NH3,其余依次推出,①为(NH4)2CO3或NH4HCO3,⑥为NO,⑦为NO2,⑧为HNO3,⑨为C,⑩为MgO,⑩为H2O。
本题难度:一般