微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列溶液中Cl-浓度最大的是( )
A.10mL0.2mol/L的FeCl3溶液
B.10mL 0.1mol/L的AlCl3溶液
C.20mL0.1mol/L的MgCl2溶液
D.20mL 0.1mol/L的HCl溶液
参考答案:A、10mL0.2mol/L的FeCl3溶液中Cl-浓度0.2mol/L×3=0.6mol/L;
B、10mL 0.1mol/L的AlCl3溶液中Cl-浓度0.1mol/L×3=0.3mol/L;
C、20mL0.1mol/L的MgCl2溶液中Cl-浓度0.1mol/L×2=0.2mol/L;
D、20mL 0.1mol/L的HCl溶液Cl-浓度0.1mol/L×1=0.1mol/L;
综上所述Cl-浓度最大的是10mL0.2mol/L的FeCl3溶液,
故选A.
本题解析:
本题难度:一般
2、计算题 (12分)
(1)标准状况下,体积约为11.2 L的NH3中约含有?个分子、含有?个质子。
(2)同温同压下,同质量的氨气和硫化氢气体(H2S)的体积比为?。同温同压下,若二者氢原子数相等,它们的体积比为?。
(3)在某温度时,一定量的元素A的氢化物AH3在一定体积密闭容器中可完全分解成两种气态单质,此时密闭容器中气体分子总的物质的量增加了75%。则A单质的一个分子中有_____个A原子,AH3分解反应的化学方程式为___________________。
参考答案:(1)3.01×1023(2分) 3.01×1024(2分)
(2)2︰1(2分) 2︰3(2分)
(3)4(2分) 4AH3 = A4+6H2(2分)
本题解析:考查物质的量的有关计算。
(1)根据标准状况下的气体摩尔体积可知,11.2L氨气的物质的量是11.2L÷22.4L/mol=0.5mol。因此含有的分子数是10×0.5mol×6.02×1023/mol=3.01×1023。氨气分子中含有10个质子,所以含有的质子数是0.5mol×6.02×1023/mol=3.01×1024。
(2)同质量的氨气和硫化氢气体(H2S)的物质的量之比是34︰17=2︰1,所以根据阿伏加德罗定律可知,二者的体积之比是2︰1;根据二者的化学式可知,同温同压下,若二者氢原子数相等,它们的体积比为1/3︰1/2=2︰3。
(3)该氢化物分解的方程式是2xAH3 ="2" Ax+3xH2,由于密闭容器中气体分子总的物质的量增加了75%。,则有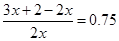 ,解得x=4,即A单质的一个分子中有4个原子,反应的方程式是4AH3 = A4+6H2。
,解得x=4,即A单质的一个分子中有4个原子,反应的方程式是4AH3 = A4+6H2。
本题难度:一般
3、填空题 如图所示是分离混合物时常用的仪器及实验室硫酸试剂标签,回答下列问题:
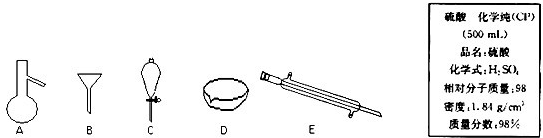
(1)写出仪器C、E的名称______、______.
(2)分离以下混合物应该主要选用使用什么仪器?(填字母符号)粗盐和泥沙:______?花生油和水:______.
(3)计算标签上硫酸的物质的量浓度为______.
参考答案:(1)仪器C、E的名称分别为:分液漏斗、冷凝管,故答案为:分液漏斗、冷凝管;
(2)过滤是把不溶于液体的固体物质跟液体分离开来的一种方法,泥沙不溶于水,粗盐溶于水,可用过滤的方法分离,过滤时用漏斗,故选:B;
根据分液是分离互不相溶的两种液体的方法,花生油和水是互不相溶的两种液体,可用分液的方法分离,分液时用分液漏斗,故选:C;
(3)浓硫酸的物质的量浓度c=1000ρwM=1000×1.84×98%98mol/L=18.4?mol/L,故答案为:18.4?mol/L.
本题解析:
本题难度:一般
4、简答题 将0.05mol/l的盐酸和未知浓度的氢氧化钠溶液以1:2的体积比混合,所得溶液pH值为12,用上述氢氧化钠溶液滴定pH=3的某一元弱酸溶液20ml,达到终点时,消耗氢氧化钠溶液12.5ml,试求:
(1)氢氧化钠溶液的物质的量浓度?
(2)此一元弱酸的物质的量浓度?
参考答案:(1)假设NaOH的浓度为amol/L.混合时盐酸的体积为VL,NaOH的体积为2VL,混合后溶液的总体积为3VL.又因为混合后溶液pH值为12,说明碱过量,根据溶液中剩余的OH-的量得到等式:2Va-0.05V=0.01×3V,从而解得a=0.04mol/L,
答:氢氧化钠溶液的物质的量浓度为0.04mol/L;
(2)设弱酸物质的量浓度为x,其物质的量为20×10-3x mol,到达滴定终点时,与NaOH完全中和,则有20×10-3 x=12.5×10-3 L×0.04 mol?L-1,从而解得x=0.025 mol?L-1.
答:一元弱酸的物质的量浓度为0.025 mol?L-1.
本题解析:
本题难度:一般
5、选择题 在t ℃时,将a g NH3完全溶于水,得到V mL溶液,假设该溶液的密度为ρ g·mL-1,质量分数为w,其中含有NH4+的物质的量是b mol,下列叙述正确的是(?)
A.溶质的质量分数w=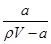 ×100%
×100%
B.溶质的物质的量浓度c=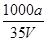 mol·L-1
mol·L-1
C.溶液中c(OH-)= mol·L-1+c(H+)
mol·L-1+c(H+)
D.向上述溶液中加入V mL水,所得溶液的质量分数大于0.5w
参考答案:C
本题解析:A、氨水溶液溶质为氨气,该溶液的密度为ρg·mL-1,体积为VmL,所以溶液质量为ρVg,溶质氨气的质量为ag,溶质的质量分数为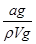 ×100%,故A错误;B、a g NH3的物质的量为
×100%,故A错误;B、a g NH3的物质的量为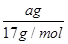 =
=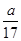 mol,溶液体积为VmL,所以溶液的物质的量浓度为
mol,溶液体积为VmL,所以溶液的物质的量浓度为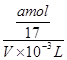 =
= mol·L-1,故B不正确;C、V?mL饱和溶液中n(OH-)=n(H+)+n(NH4+)=[c(H+)×10-3+b]mol,所以
mol·L-1,故B不正确;C、V?mL饱和溶液中n(OH-)=n(H+)+n(NH4+)=[c(H+)×10-3+b]mol,所以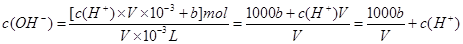 ,C正确;D、混合前后溶质的质量不变为ag,水的密度比氨水的密度大,即ρg·cm-3<ρ水,等体积Vml混合,混合后溶液的质量大于2ρvg,所以混合后质量分数小于0.5ω,故D不正确.选C。
,C正确;D、混合前后溶质的质量不变为ag,水的密度比氨水的密度大,即ρg·cm-3<ρ水,等体积Vml混合,混合后溶液的质量大于2ρvg,所以混合后质量分数小于0.5ω,故D不正确.选C。
本题难度:一般