微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列情况下,溶液中可能大量存在的离子组是
A.无色溶液中:H+、Na+、I-、ClO-
B.FeCl3溶液:K+、Na+、SO42-、AlO2-
C.pH=1的溶液中:K+、Fe2+、NO3-、Cl-
D.常温条件下,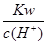 ="0.1" mol/L的溶液:Na+、K+、SiO32-、CO32-
="0.1" mol/L的溶液:Na+、K+、SiO32-、CO32-
2、填空题 下表是几种弱电解质的电离平衡常数、难溶电解质的溶度积Ksp(25℃)。
电解质
| 电离方程式
| 电离常数K
| Ksp
|
H2CO3
| H2CO3 HCO3-+H+ HCO3-+H+
HCO3- CO32-+H+ CO32-+H+
| K1=4.31×10-7
K2=5.61×10-11
| -
|
C6H5OH
| C6H5OH C6H5O-+H+ C6H5O-+H+
| 1.1×10-10
| -
|
H3PO4
| H3PO4 H2PO4-+H+ H2PO4-+H+
H2PO4- HPO42-+H+ HPO42-+H+
HPO42- PO43-+H+ PO43-+H+
| K1=7.52×10-3
K2=6.23×10-6
K1=2.20×10-13
| -
|
NH3·H2O
| NH3·H2O OH-+NH4+ OH-+NH4+
| 1.76×10-5
| -
|
BaSO4
| BaSO4(s) Ba2++SO42- Ba2++SO42-
| -
| 1.07×10-10
|
回答下列问题:
(1)写出C6H5OH与Na3PO4反应的离子方程式:_________________。
(2)25℃时,向10 mL 0. 01 mol/LC6H5OH溶液中滴加V mL 0.1 mol/L氨水,混合溶液中粒子浓度关系正确的是__________(填序号)。
a.若混合液pH>7,则V≥10
b.V=5时,2c(NH3·H2O)+2c(NH4+)=c(C6H5OH)+c(C6H5O-)
c.V=10时,混合液中水的电离程度小于0.01 mol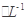 C6H5OH溶液中水的电离程度
C6H5OH溶液中水的电离程度
d.若混合液pH<7,则c(NH4+)>c(C6H5O-)>c(H+)>c(OH-)
(3)水解反应的化学平衡常数称为水解常数(用Kb表示),类比化学平衡常数的定义。25℃时,Na2CO3第一步水解反应的水解常数Kb=____mol/L。
(4)如图所示,有T1、T2不同温度下两条BaSO4在水中的沉淀溶解平衡曲线(已知BaSO4的Ksp随温度升高而增大)。
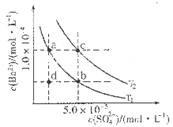
①T2____ 25℃(填“>”、“<”或“=”);
②讨论T1温度时BaSO4的沉淀溶解平衡曲线,下列说法正确的是____(填序号)。
a.加入Na2SO4不能使溶液由a点变为b点
b.在T1曲线上方区域(不含曲线)任意一点时,均有BaSO4沉淀生成
c.蒸发溶剂可能使溶液由d点变为曲线上a、b之间的某一点(不含a、b)
d.升温可使溶液由b点变为d点
3、选择题 下列各组物质能大量共存于水溶液中的是( )
A.CuSO4和KOH
B.Ba(NO3)2和Na2CO3
C.CaCl2和Zn(NO3)2
D.HCl和AgNO3