微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 A与芳香族化合物B在一定条件下反应生成C,进一步反应生成抗氧化剂阿魏酸。
A的相对分子质量是104,1 molA与足量NaHCO3反应生成2 mol气体。已知:
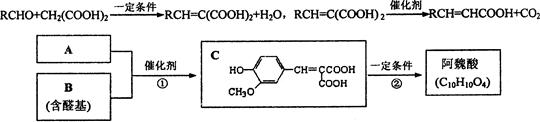
(1)C可能发生的反应是?(填序号)。
a.氧化反应? b.水解反应? c.消去反应? d.酯化反应
(2)等物质的量的C分别与足量的Na、NaHCO3、NaOH反应时消耗Na、NaHCO3、NaOH的物质的量之比是?。
(3)A的分子式是?。
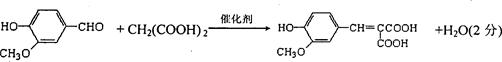
(4)反应①的化学方程式是?。
(5)符合下列条件的阿魏酸的同分异构体有?种,写出其中任意一种的结构简式?。
①在苯环上只有两个取代基;②在苯环上的一氯取代物只有两种;
③1 mol该同分异构体与足量NaHCO3反应生成2 molCO2。
参考答案:
(1)a、d(1分);? (2)3:2:3(1分);? (3)C3H4O4(1分);
(4)
(5)4种(2分)(写出下列四种结构中的任意一种均可得2分)
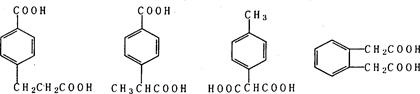
本题解析:
本题考查有机合成与推断。关键在于依据信息找到突破点。依据题目信息及框图变化关系,A的结构为HOOCCH2COOH,相对分子质量为104,则B为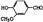 ,故阿魏酸为
,故阿魏酸为 。1 mol该同分异构体与足量NaHCO3反应生成2 molCO2,说明同分异构体有两个羧基,则同分异构体为
。1 mol该同分异构体与足量NaHCO3反应生成2 molCO2,说明同分异构体有两个羧基,则同分异构体为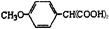 。
。
本题难度:一般
2、选择题 等物质的量的下列各组有机物,完全燃烧时消耗氧气的量相同的是?
A.乙醇和甲醚
B.乙炔和苯
C.甲醛和葡萄糖
D.甲烷和乙烷
参考答案:A
本题解析:根据有机物燃烧的通式CnHmOz+(n+m/4-z/2)O2=nCO2+m/2H2O可知,在物质的量相等的条件下,完全燃烧消耗的氧气与(n+m/4-z/2)有关系,即(n+m/4-z/2)越大,消耗的氧气越多,所以根据物质的化学式可知,选项A中物质互为同分异构体,消耗的氧气相等,答案选A。
点评:该题是中等难度的试题,试题基础性强,侧重能力的培养和计算方法技巧的培养,有助于培养学生的逻辑推理能力和创新思维能力。该题还需要注意的是,如果有机物的质量相等时,会出现什么情况,学生应该注意发散思维的培养。
本题难度:一般
3、选择题 在标准状况时密度为2.5g/L的是
A.C4H8
B.C2H4
C.C2H2
D.CH4
参考答案:A
本题解析:
正确答案:A
摩尔质量为22.4l/mol×2.5g/L=56g·mol-1,A正确。
本题难度:一般
4、实验题 (10分)苯甲酸乙酯(C9H10O2)稍有水果气味,用于配制香水香精和人造精油,大量用于食品工业中,也可用作有机合成中间体、溶剂等。其制备方法为:

实验步骤如下:
①在100 mL圆底烧瓶中加入12.20 g苯甲酸、25mL乙醇(过量)、20mL环己烷,以及4mL浓硫酸,混合均匀并加入沸石,按左上图所示装好仪器,控制温度在65~70℃加热回流2h。反应时环己烷-乙醇-水会形成“共沸物”(沸点62.6℃)蒸馏出来。再利用分水器不断分离除去反应生成的水,回流环己烷和乙醇。
②反应结束,打开旋塞放出分水器中液体后,关闭旋塞。继续加热,至分水器中收集到的液体不再明显增加,停止加热。
③将烧瓶内反应液倒入盛有适量水的烧杯中,分批加入Na2CO3至溶液呈中性。
④用分液漏斗分出有机层,水层用25mL乙醚萃取分液,然后合并有机层。加入氯化钙,对粗产品进行蒸馏(装置如图所示)。低温蒸出乙醚后,继续升温,接收210~213℃的馏分。
⑤检验合格,测得产品体积为12.86mL.
回答下列问题:
⑴步骤①中使用分水器不断分离除去水的目的是?。
⑵步骤②中应控制馏分的温度在?。
A.65~70℃
B.78~80℃
C.85~90℃
D.215~220℃