微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+
CH3OH(g)+
H2O(g),该反应的能量变化如图所示

(1)上述反应平衡常数K的表达式为________,温度降低,平衡常数K_______(填“增大”、“不变”或 “减小”)。
(2)在体积为2L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5min末,用氢气浓度变化表示的平均反应速率v(H2)=________。

(3)在相同温度容积不变的条件下,能说明该反应已达平衡状态的是________(填写序号字母)。
a.n(CO2):n(H2):n(CH3OH):n(H2O)=1:3:1:1
b.容器内压强保持不变
c.H2的消耗速率与CH3OH的消耗速率之比为3:1
d.容器内的密度保持不变
(4)下列条件能使上述反应的反应速率增大,且平衡向正反应方向移动的是_______(填写序号字母)。
a.及时分离出CH3OH气体
b.适当升高温度
c.保持容器的容积不变,再充入1mol CO2和3 mol H2
d.选择高效的催化剂
参考答案:(1) ;增大
;增大
(2)0.15 mol·L-1·min-1
(3)bc
(4)c
本题解析:
本题难度:一般
2、选择题 SO2的催化氧化反应(2SO2+O2?2SO3)是一个放热的反应.如果反应在密闭容器中进行,下列有关说法中正确的是( )
A.因为反应放热,所以升高温度会使反应速率减慢
B.通过调控反应条件,SO2可以100%地转化为SO3
C.当SO2与SO3的浓度相等时,反应达到平衡
D.使用催化剂的目的是加快反应速率,提高生产效率
参考答案:该反应是前后气体体积减小的放热反应.
A、温度对化学反应速率影响是温度升高,速率增大,只是平衡逆向进行,故A错误;
B、该反应是可逆反应,所以该反应存在反应限度,反应物不可能100%的转化,故B错误;
C、达到平衡时,SO2的浓度与SO3的浓度可能相等,也可能不相等,要依据反应物的初始浓度及转化率,故C错误;
D、使用催化剂加快了反应速率,缩短反应时间,提高反应效率,故D正确;
故选D.
本题解析:
本题难度:简单
3、选择题 已知反应A2(g)+2B2(g)

2AB2(g)(正反应放热),下列说法正确的( )
A.升高温度,正向反应速率减小,逆向反应速率增加
B.升高温度有利于反应速率增加,从而缩短达到平衡的时间
C.达到平衡后,升高温度或增大压强都有利于该反应平衡正向移动
D.达到平衡后,降低温度或减小压强都有利于该反应平衡正向移动
参考答案:B
本题解析:
本题难度:一般
4、选择题 某学习小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量)

根据以上规律判断,上列结论正确的是
[? ]
A.?反应Ⅰ:ΔH<0,P2>P1?
B. 反应Ⅱ:ΔH>0,T1<T2
C.?反应Ⅲ:T1加入了催化剂,降低活化能?
D.?反应Ⅳ:ΔH<0,T2>T1
参考答案:A
本题解析:
本题难度:一般
5、填空题 在一定条件下,二氧化碳和氧气发生如下反应:
2SO2(g)+ O2 (g)  2SO3(g) + Q (Q>0)
2SO3(g) + Q (Q>0)
(1)写出该反应的化学平衡常数表达式 K= ____________。
(2)降低温度,该反应K值________ ,二氧化碳转化率__________ ,化学反应速度___________。(以上均填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化碳和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是_______________ 。

(4)据图判断,反应进行至20min时,曲线发生变化的原因是_____________ (用文字表达) 10min到15min的曲线变化的原因可能是__________ (填写编号)。
a.加了催化剂
b.缩小容器体积
c.降低温度
d.增加SO3的物质的量
参考答案:(1)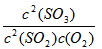
(2)增大; 增大 ;减小
(3)15-20 min和25-30 min
(4)增加了O2的量 ;a b
本题解析:
本题难度:一般