微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 一定量的铜和浓硫酸在加热条件下充分反应,向反应后的溶液中逐滴加入含a mol NaOH的溶液,恰好使反应后的溶液呈中性,则下列叙述错误的是( )
A.溶液中c(Na+)=2c(SO42-)
B.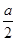 mol>沉淀的物质的量>0
mol>沉淀的物质的量>0
C.沉淀的物质的量=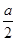 mol
mol
D.原浓硫酸中H2SO4的物质的量>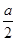 mol
mol
参考答案:C
本题解析:铜和浓硫酸反应后的溶液中含有CuSO4和H2SO4,加入含a mol NaOH的溶液后显中性,此时溶液中的溶质为Na2SO4,Cu2+完全沉淀,A项正确;n(CuSO4)<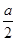 ?mol,故B项正确,C项错;由于有一部分浓硫酸被还原为SO2,故n(H2SO4)>
?mol,故B项正确,C项错;由于有一部分浓硫酸被还原为SO2,故n(H2SO4)>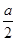 ?mol,D项正确。
?mol,D项正确。
本题难度:一般
2、选择题 NA表示阿伏加德罗常数,下列说法正确的是 ( )
A.1 mol Na与 O2完全反应生成Na2O或Na2O2均失去NA个电子
B.1mol Na2O2与足量CO2反应时,转移2NA个电子
C.1mol·L-1的NaOH溶液中含Na+数目为NA
D.23gNa+中含有的电子数为NA
参考答案:A
本题解析:A 正确,1 mol Na生成钠离子,都失去1mol电子,即均失去NA个电子
B 错误,1mol Na2O2与足量CO2反应时,转移NA个电子
C 错误,没有给溶液体积,无法求溶质的物质的量
D 错误,23gNa+中含有的电子数为10NA
本题难度:一般
3、选择题 设NA为阿伏加德罗常数的值。下列叙述正确的是(?)
A.1 mol甲醇中含有C—H键的数目为4NA
B.25 ℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA
C.标准状况下,2.24 L己烷含有分子的数目为0.1NA
D.常温常压下,Na2O2与足量H2O反应,共生成0.2 mol O2,转移电子的数目为0.4NA
参考答案:D
本题解析:在审准各项条件的基础上还要注意以下几点:
(1)甲醇中含有C—O键。
(2)溶液中微粒的个数与溶液的体积有关。
(3)应用气体摩尔体积时要注意物质的状态。
A项,1个甲醇分子中含3个碳氢键,1 mol甲醇中含3 mol碳氢键,A项错误;B项,缺少溶液的体积,无法计算,B项错误;C项,标准状况下,己烷为液态,不能使用22.4 L·mol-1进行计算,C项错误;D项,过氧化钠与水反应,每生成1个氧气分子转移2个电子,生成0.2 mol氧气,转移的电子数为0.4NA,D项正确。
本题难度:一般
4、选择题 设阿伏加德罗常数为NA,标准状况下,mg N2和O2的混合气体含有b个分子,则ng该混合气体在相同状态下的体积为(单位为L)(? )
A.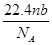
B.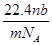
C.
D.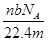
参考答案:B
本题解析:mg混合气体的物质的量为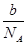 mol,所以ng该混合气体的物质的量为
mol,所以ng该混合气体的物质的量为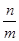 ×
×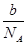 mol,标准状况下的该气体体积为
mol,标准状况下的该气体体积为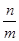 ×
×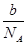 mol×22.4 L/mol=
mol×22.4 L/mol=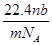 L。
L。
本题难度:一般
5、选择题 配制一定物质的量浓度的溶液时,下列做法会使配得的溶液浓度偏高的是(?)
A.容量瓶中含有少量蒸馏水
B.将溶液从烧杯转移到容量瓶中后没有洗涤烧杯
C.定容时观察液面俯视
D.定容时倒转容量瓶几次,发现凹液面最低点低于标线,再补几滴水到标线
参考答案:C
本题解析:A、容量瓶中含有少量蒸馏水,对实验结果没影响,错误;B、将溶液从烧杯转移到容量瓶中后没有洗涤烧杯,将会有一部分的溶质没有转移到容量瓶中,导致浓度偏低,错误;C、定容时观察液面俯视,因为光线要通过刻度线,还要通过凹液面的最低点,因此加的水少了,导致结果偏高,正确;D、定容时倒转容量瓶几次,发现凹液面最低点低于标线,再补几滴水到标线,导致水的量加多,使浓度偏低,错误。
本题难度:一般