微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
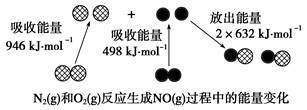
下列说法正确的是(?)
A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ
B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量
C.通常情况下,N2(g)和O2(g)混合能直接生成NO
D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
参考答案:B
本题解析:A、根据题给数据可知,反应物中化学键断裂吸收能量:(946+498)=1444kJ/mol,生成物中化学键的形成放出能量2×632=1264?kJ/mol,故1 mol N2(g)和1 mol O2(g)反应吸收的能量为180 kJ,错误;B、根据题给数据知,N2(g)和O2(g)的反应是吸热反应, 1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量,正确;C、N2(g)和O2(g)的反应需要在放电条件下进行,通常情况下,N2(g)和O2(g)混合不能直接生成NO,错误;D、一氧化氮不能和氢氧化钠反应,属于不成盐氧化物,错误。
本题难度:一般
2、选择题 下列热化学方程式书写正确的是( 的绝对值均正确)( )
的绝对值均正确)( )
A.C2H5OH(l)+3O2(g)==2CO2(g)+3H2O(g);△H="—1367.0" kJ/mol(燃烧热)
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l);△H=+57.3kJ/mol(中和热)
C.S(s)+O2(g)===SO2(g);△H=—269.8kJ/mol(反应热)
D.2NO2==O2+2NO;△H=+116.2kJ/mol(反应热)
参考答案:C
本题解析:燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,水应该是液态稳定,A不正确。中和反应是放热反应,△H小于0,B不正确。D不正确,没有注明状态。所以正确的答案是C。
本题难度:一般
3、实验题 (12分)50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
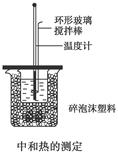
(1)烧杯间填满碎泡沫塑料的作用是__________________________________________ ______________________________。
(2)大烧杯上如不盖硬纸板,求得的中和热数值________(填“偏大”“偏小”“无影响”)。
(3)实验中改用60 mL 0.50 mol·L-1盐酸进行反应,与上述实验相比,所放出的热量________(填“相等”、“不相等”),所求中和热__________(填“相等”、“不相等”),简述理由_____________________________________________________________________
________________________________________________________________________________________________________________________________________________。
(4)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会________(填“偏大”、“偏小”“无影响”)。
参考答案:(1)减小热量散失 (2)偏小
(3)不相等 相等 因中和热是指稀强酸与稀强碱发生中和反应生成1 mol H2O放出的热量,与酸碱的用量无关
(4)偏小
本题解析:(2)大烧杯上如不盖硬纸板,则会造成热量损失,测得的中和热数值偏小;
(3)反应物的用量改变,放出的热量改变,但中和热数值不变(中和热指稀强酸和稀强碱反应生成1 mol H2O放出的热量,是定值);
(4)氨水是弱碱,电离吸热,必然使放出热量减少。
本题难度:一般
4、选择题 下列事实中不能用勒夏特列原理来解释的是(?)
A.向H2S水溶液中加入NaOH有利于S2-增多
B.鼓入过量空气有利于SO2转化为SO3
C.高压对合成氨有利
D.500 ℃左右比室温更有利于合成氨的反应 (合成氨反应是放热反应)
参考答案:D
本题解析:如果改变影响平衡的一个条件,则平衡就向能够减弱这种改变的方向进行,这就是勒夏特列原理,该原理适用于所有的平衡体系。氨气的合成是放热反应,根据勒夏特列原理可知,高温不利于氨气的合成,所有答案选D。
本题难度:简单
5、填空题 下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
物质
| Cl2
| Br2
| I2
| HCl
| HBr
| HI
| H2
|
能量/kJ
| 243
| 193
| 151
| 432
| 366
| 298
| 436
|
?
根据上述数据回答(1)~(5)题。
(1)下列物质本身具有的能量最低的是 。?
A.H2? B.Cl2? C.Br2? D.I2
(2)下列氢化物中,最稳定的是 。?
A.HCl B.HBr C.HI
(3)X2+H2 2HX(X代表Cl、Br、I )的反应是吸热反应还是放热反应?答: ______________。?
2HX(X代表Cl、Br、I )的反应是吸热反应还是放热反应?答: ______________。?
(4)相同条件下,X2(X代表Cl、Br、I)分别与氢气反应,当消耗等物质的量的氢气时,放出或吸收的热量最多的是 。?
(5)若无上表中的数据,你能正确回答出问题(4)吗?
答: ,你的根据是 ______________________。?
参考答案:(1)A(2)A(3)放热反应(4)Cl2
(5)能 元素的非金属性越强,生成的氢化物越稳定,反应放出的能量就越多
本题解析:破坏1 mol物质的化学键时所消耗的能量与相同条件下由形成该物质的原子形成1 mol该物质的化学键放出的能量相等;放出的能量越多,物质本身具有的能量越低,分子越稳定。(1)生成1 mol H2时放出的能量最多,为436 kJ;(2)在氢化物中,生成1 mol HCl时放出的能量最多,为432 kJ;(3)分别计算出三个反应放出的热量依次为:185 kJ、103 kJ和9 kJ。
本题难度:一般