微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列叙述中,正确的是( )
A.在多电子的原子里,能量高的电子通常在离核近的区域内活动
B.离子化合物熔化时破坏离子键,是其熔化状态导电的原因
C.化学键是相邻的分子之间强烈的相互作用
D.氯化氢气体溶于水,有共价键的断裂,是化学变化
参考答案:B
本题解析:
本题难度:一般
2、简答题 (物质结构)下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素.请根据上表回答下列问题:
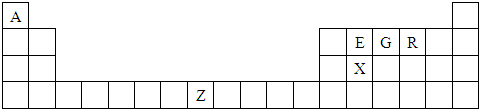
(1)G元素基态原子的电子排布式为______,其气态氢化物易液化,其原因是______.
(2)XR2中,X原子的轨道杂化类型为______,化合物ER2的熔点较XR2低,其原因是______.
(3)E、G、R三种元素的第一电离能由大到小的顺序是______(用元素符号填空).
(4)由A、E、G、R四种元素所形成的微粒中互为等电子体的有多组,请写出其中两组的化学式______.
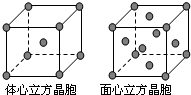
(5)单质Z的晶体在1183K以下时为体心立方堆积,在1183K以上时为面心立方堆积,其晶胞结构如图所示.则体心立方晶胞和面心立方晶胞中实际含有的Z原子的个数之比为______.Z3+比Z2+更稳定一些,其原因可能是______.
参考答案:由元素在周期表中的位置可知,A为H,E为C,G为N,R为O,X为Si,Z为Fe,
(1)N的质子数为7,其电子排布式为1s22s22p3,因氨分子之间有氢键,则沸点高,易液化,故答案为:1s22s22p3;氨分子之间有氢键;
(2)SiO2中Si能形成4个Si-O键,则Si原子采取sp3杂化,又CO2属于分子晶体,SiO2属于原子晶体,则SiO2的熔点高,
故答案为:sp3;CO2属于分子晶体,SiO2属于原子晶体;
(3)非金属性越强,C的非金属性最弱,则C的第一电离能越大,但N原子的p轨道半满更稳定,失电子较难,则N的第一电离能最大,则
第一电离能由大到小的顺序为N>O>C,故答案为:N>O>C;
(4)因CH4和NH4+、NH3和H3O+、CO2和N2O、CO和N2中原子数目相同、价电子数相同,则它们属于等电子体,故答案为:CH4和NH4+、NH3和H3O+;
(5)体心立方晶胞中Fe原子在顶点和体心,则原子个数为1+8×18=2,面心立方晶胞中Fe原子在顶点和面心,原子个数为8×18+6×12=4,
则实际含有的Z原子的个数之比为2:4=1:2;又因Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态,则Fe3+比Fe2+更稳定一些,
故答案为:1:2;Fe2+转化为Fe3+时,3d能级由不稳定的3d6状态转变为较稳定的3d5半充满状态.
本题解析:
本题难度:一般
3、选择题 原子核外电子是分层排布的,在不同电子层上运动着的电子能量是不同的,下列电子层上运动的电子能量最高的是( )
A.L层
B.K层
C.N层
D.M层
参考答案:原子核外电子是分层排布的,距离原子核越近能量越低,所以N层能量最高,故C正确;
故选C.
本题解析:
本题难度:一般
4、填空题 铜(Cu)是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答下列问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为__________________;
(2)CuSO4粉末常用来检验一些有机物的微量水分,其原因是__________________;
(3)SO42-的立体构型是__________,其中S原子的杂化轨道类型是___________;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为___________;一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为________;该晶体中,原子之间的作用力是__________;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式应为___________。
参考答案:(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)无水硫酸铜可与水结合生成蓝色的CuSO4·5H2O,因而通过观察可得结论
(3)正四面体;sp3
(4)5d106s1;3:1;金属键
(5)H4AuCu3
本题解析:
本题难度:一般
5、选择题 下列各项表述中与示意图一致的是( )
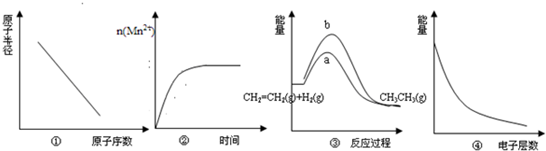
A.图①表示IA族元素原子半径的变化规律
B.图②表示10mL0.01mol?L-1KMnO4酸性溶液与过量的0.1mol?L-1H2C2O4溶液混合时,n(Mn2+)随时间的变化
C.图③中a、b曲线分别表示反应:CH2=CH2(g)+H2(g)→CH3CH3(g)△H<0在使用和未使用催化剂时,反应过程中的能量变化
D.图④表示核外电子能量与电子层数的关系
参考答案:A.IA族元素随原子序数的增大,原子半径在增大,则曲线应为上升趋势,与图象不符,故A错误;
B.n(Mn2+)开始为0,随反应的发生,增大,氧化还原反应结束后,其物质的量不再变化,与图象一致,故B正确;
C.催化剂降低反应所需的活化能,反应的始态、终态相同,曲线a为使用催化剂的情况,与图象一致,故C正确;
D.一般电子层数越多,最外层电子的能量越高,图象中电子层多的能量低,二者不一致,故D错误;
故选BC.
本题解析:
本题难度:简单