微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 某元素的原子核外有三个电子层,其最外层电子数是次外层电子数的一半,则此元素是( )
A.C
B.Si
C.S
D.C1
2、简答题 目前,全世界镍的消费量仅次于铜、铝、铅、锌,居有色金属第五位.镍行业发展蕴藏着巨大潜力.
(1)配合物Ni(CO)4常温为液态,易溶于CCl4、苯等有机溶剂.固态Ni(CO)4属于______晶体;基态Ni原子的电子排布式为______.
(2)配合物
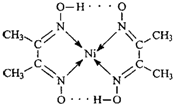
分子内的作用力有______(填编号).
A.氢键? B.离子键? C.共价键? D.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应.如①CH2=CH2、②CH≡CH、③
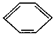
、④HCHO等,其中碳原子采取sp2杂化的分子有______(填物质序号),预测HCHO分子的立体结构为______形.
(4)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料.该合金的晶胞如图所示,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点.该晶体的化学式______.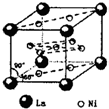
3、选择题 下列各组由价电子排布确定的因素,不能形成AB2型化合物的是( )
A.2s22p2和2s22p4
B.3s23p4和2s22p4
C.3s2和2s22p5
D.3s1和3s23p5
4、简答题 氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用.请回答下列问题.
(1)砷原子核外电子排布式为______.
(2)K3[Fe(CN)6]晶体中Fe3-与CN-之间的键型为______,该化学键能够形成的原因是______.
(3)NH4+中氮原子的杂化类型为______,NH4+的空间构型为______.
(4)已知:
| CH4 | SiH4 | NH3 | PH3
沸点(K)
101.7
161.2
239.7
185.4
分解温度(K)
873
773
1073
713.2
|
分析上表中四种物质的相关数据,请回答:
①CH4和SiH4比较,NH3和PH3比较,沸点高低的原因是______;
②CH4和SiH4比较,NH3和PH3比较,分解温度高低的原因是______;
结合上述数据和规律判断,一定压强下HF和HC1的混合气体降温时______先液化.
(5)电负性(用X表示)也是元素的一种重要性质,下表给出8种元素的电负性数值:
| 元素 | Na | Mg | Al | Si | P | S | Cl | K
电负性
0.9
1.2
1.5
1.8
2.1
2.5
3.0
0.8
|
请回答下列有关问题:
①估计钙元素的电负性的取值范围:______<X<______.
②经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键.试推断AIC13中形成的化学键的类型及其理由是______.
5、填空题 根据下列叙述,写出微粒符号.
(1)原子核外有2个电子层,核外有10个电子的原子______;
(2)原子核外有3个电子层,最外层有7个电子的原子______;
(3)质量数为24,质子数等于中子数的离子______.