微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、填空题 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.T℃时反应2SO2(g)+O2(g)

2SO3(g)过程中的能量变化如图所示,回答下列问题.
(1)写出该反应的热化学方程式(用E1、E2或E3表示,下同)______.
(2)T℃时将3m来源:91考试网 91ExaM.orgolSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生反应.2min时反应达到平衡,此时测得反应物O2还剩余0.1mol,则达到平衡时SO2的转化率为______,反应______(填“放出”或“吸收”)______热量.(用E1、E2或E3表示)
(3)下列叙述能证明该反应已达化学平衡状态的是______(填序号)
①SO2的体积分数不再发生变化?②容器内压强不再发生变化?③容器内气体原子总数不再发生变化?④相同时间内消耗2n?molSO2的同时生成n?molO2?⑤相同时间内消耗2n?molSO2的同时生成2n?molSO3
(4)在反应体系中加入催化剂,反应速率增大,E1、E2和E3的变化是:E1______,E2______,E3______(填“增大”“减小”或“不变”).
(5)若以如图所示装置,用电化学原理生产硫酸,将SO2、O2以一定压强喷到活性电极上反应.写出两电极的电极反应式:______,为稳定持续生产,硫酸溶液的浓度应维持不变,则通入SO2和水的质量比为______.
(6)SOCl2是一种无色液体,可与碳共同构成锂电池的正极材料,且其放电时也有SO2气体产生.写出SOCl2在电池中放电时的电极反应式______.

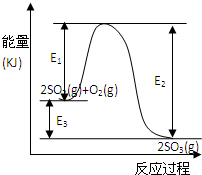
参考答案:(1)△H=反应物吸收的能量-生成物放出的能量═-E3kJ/mol=-(E2-E1)kJ/mol,
故答案为:2SO2(g)+O2(g)?2SO3(g)△H=-E3kJ/mol 或△H=-(E2-E1)kJ/mol
(2)从图象知,反应物的能量大于生成物的能量,所以该反应是放热反应.
? 2SO2(g)+O2(g)?2SO3(g)?放热 E3?
? 反应开始?3 mol? 1mol? 0? E3
? 转化?1.8 mol? 0.9mol? 1.8 mol? 0.9E 3
? 平衡?1.2mol? 0.1mol? 1.8 mol?
? 所以SO2的转化率=1.8mol?3mol×100%=60%
放出热量 0.9E 3
故答案为:60%;放出; 0.9 E3;
(3)该反应前后气体体积减小,化学平衡状态的标志:正逆反应速率相等、体系各物质的含量不变.
①②④符合条件;根据原子守恒,各元素的原子总数始终不变,故③错;⑤所指方向一致,故⑤错.
故选:①②④;
(4)加入催化剂,改变了反应历程,改变反应速率,但平衡不移动,所以E2、E1 减小,E3不变,
故答案为:E2、E1 减小,E3不变;
(5)根据原电池反应原理,还原剂在负极上发生氧化反应电极反应式为SO2-2e-+2H2O═SO42-+4H+;,氧化剂在正极上发生还原反应电极反应式为O2+4e-+4H+═2H2O,该原电池的本质是2SO2+O2+2H2O=2H2SO4,为维持浓度不变,SO2和O2反应生成硫酸的质量分数是50%,所需的水为反应反应的水和做溶剂的水,所以质量比为=2×64:(2×18+2×98)=16:29
故答案为:+:O2+4e-+4H+═2H2O,-:SO2-2e-+2H2O═SO42-+4H+; 16:29;
(6)SOCl2中S的化合价是+4价,是中间价态,能发生氧化还原反应,反应中有二氧化硫生成,也有S单质生成,电池反应式为2SOCl2+4e-═S+SO2↑+4Cl-,
故答案为:2SOCl2+4e-═S+SO2↑+4Cl-.
本题解析:
本题难度:一般
2、选择题 下列说法正确的是
A.右图可表示水分解过程中的能量变化
B.若2C(s)+O2(g)=2CO(g)△H=" -221.0" kJ/mol,则碳的燃烧热为110.5 kJ/mol
C.需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应
D.已知:Ⅰ:对于反应:H2(g)+Cl2(s)="2HCl" (g)△H=" -" a kJ/mol,
