微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 为了提高煤燃烧的热效率并减少SO2和烟尘对大气的污染,适宜采取的措施是(? )
A.通入大量的空气
B.将煤块粉碎成煤粉
C.将煤制成多孔的煤球
D.将煤经过处理,转化为气体燃料
参考答案:BD
本题解析:扩大煤与氧气或空气的接触面,燃烧会更充分。
本题难度:简单
2、选择题 下列各图所表示的反应属于吸热反应的是

参考答案:A
本题解析:如果反应物的总能量高于生成物的总能量,反应就是放热反应,反之是吸热反应,A图表示吸热反应,B图表示放热反应,C、D图不符合事实,答案选A。
本题难度:一般
3、填空题 (12分)天然气(主要成分甲烷)是一种清洁、高效的能源,现在许多城市家庭用于厨房使用的燃料已经由煤气(主要成分是H2和CO按体积比1︰1混合的气体混合物)换成了天然气;此外天然气也是很好的燃料电池的燃料,甲烷在燃料电池中的能量转换率可达到85%—90%。请回答下列问题:
⑴已知H2、CO和CH4的燃烧热分别是286kJ/mol、283 kJ/mol和890 kJ/mol,则反应2CH4(g)+3O2(g)=CO(g)+H2(g)+CO2(g)+3H2O(l)的反应热△H=?。
⑵以甲烷、空气为反应物,KOH溶液作电解质溶液构成燃料电池,则负极反应式为:?。随着反应的不断进行溶液的pH?(填“增大”“减小”或“不变”)。
⑶如果以该燃料电池为电源、石墨作两极电解饱和食盐水,则该电解过程中阳极反应式为:?;如果电解一段时间后NaCl溶液的体积为1L,溶液的pH为12,则理论上消耗甲烷在标准状况下的体积为:?mL。
⑷将⑶中电解结束后的溶液取出,向其中加入含有Mg2+和Fe2+的溶液甲,Mg(OH)2和Fe(OH)2同时生成,已知Mg(OH)2和Fe(OH)2在该温度下的溶度积常数分别是2×10—11和8×10—16,则甲溶液中Mg2+和Fe2+的浓度比为:?。
参考答案:(共12分)⑴—1211kJ/mol ( 2分)
⑵CH4+10OH——8e—=CO32—+7H2O (2分)?减小(2分)
⑶2Cl——2e—=Cl2↑ (2分)? 28 (2分)?
⑷25000︰1 (2分)
本题解析:
⑴已知H2、CO和CH4的燃烧热分别是286kJ/mol、283 kJ/mol和890 kJ/mol,则① H2(g)+1/2 O2(g) = H2O(l) △H="286kJ/mol" ,② CO+1/2 O2(g) = CO2(g) △H="283" kJ/mol,③ CH4(g)+2O2(g)= CO2(g)+2H2O(l)△H="890" kJ/mol,反应2CH4(g)+3O2(g)=CO(g)+H2(g)+CO2(g)+3H2O(l)即2·③-(①+②),反应热 △H=—1211kJ/mol;
⑵负极反应为甲烷在碱性条件下失去电子即CH4+10OH——8e—=CO32—+7H2O,随着反应的不断进行, OH—的物质的量不断减少,溶液的pH减小;
⑶该电解过程中阳极Cl—失去电子发生氧化反应,即2Cl——2e—=Cl2↑;因为CH4+10OH——8e—=CO32—+7H2O ~8e—,2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑~2e—,则CH4~8e—~8NaOH溶液的体积为1L, pH为12,则NaOH物质的量为0.01mol,所以则理论上消耗甲烷在标准状况下的体积为0.01mol/8·22.4L·10-3="28" mL;
2NaOH + H2↑ + Cl2↑~2e—,则CH4~8e—~8NaOH溶液的体积为1L, pH为12,则NaOH物质的量为0.01mol,所以则理论上消耗甲烷在标准状况下的体积为0.01mol/8·22.4L·10-3="28" mL;
⑷由Mg(OH)2 和Fe(OH)2的溶解方程式和该温度下的溶度积常数可知,①[Mg2+][OH-]2=2×10—11, ②[ Fe2+][OH-]2=8×10—16,Mg2+和Fe2+的浓度比为①/②=25000︰1
点评:本题综合性比较强,主要考查原电池和电解原理;反应热的计算;溶解平衡,需要考生熟悉掌握。
本题难度:一般
4、填空题 (10分)纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
方法Ⅰ
| 用炭粉在高温条件下还原CuO
|
方法Ⅱ
| 电解法,反应为2Cu + H2O  ?Cu2O + H2↑。 ?Cu2O + H2↑。
|
方法Ⅲ
| 用肼(N2H4)还原新制Cu(OH)2
|
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是? ▲?。
(2)已知:2Cu(s)+1/2O2(g)=Cu2O(s)? △H = -169kJ·mol-1
C(s)+1/2O2(g)="CO(g)?" △H = -110.5kJ·mol-1
Cu(s)+1/2O2(g)="CuO(s)?" △H = -157kJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =? ▲ ?kJ·mol-1。
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为?▲?。
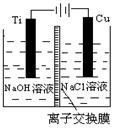
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放 出N2。该制法的化学方程式为? ▲?。
出N2。该制法的化学方程式为? ▲?。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: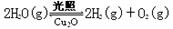 △H>0,水蒸气的浓度随时间t变化如下表所示。
△H>0,水蒸气的浓度随时间t变化如下表所示。

下列叙述正确的是? ▲?(填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率v(H2)=7×10-5 mol·L-1 min—1 ?
C.实验②比实验①所用的催化剂催化效率高
参考答案:(每空2分,共10分)(1)反应不易控制,易还原产生Cu?
(2)+34.5?(3)2Cu-2e-+2OH-=Cu2O+H2O
(4)4Cu(OH)2 + N2H4 2Cu2O + N2↑ + 6H2O?(5)BC
2Cu2O + N2↑ + 6H2O?(5)BC
本题解析:略
本题难度:一般
5、选择题 下列说法中,错误的是(?)
A.人类目前所直接利用的能量大部分是由化学反应产生的
B.煤、石油、天然气是当今世界最重要的三种化石燃料
C.我国目前最主要的能源是煤炭
D.人体运动所消耗的能量与化学反应无关
参考答案:D
本题解析:人体内无时无刻都在进行成千上万的化学反应,由它们来提供运动所需的能量
本题难度:简单