微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 下列实验装置及操作正确的是( )
A.制备乙酸乙酯

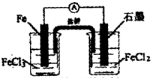
B.构成原电池
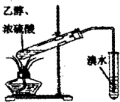
C.检验有无乙烯生成
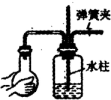
D.检查装置气密性
参考答案:D
本题解析:
本题难度:一般
2、填空题 铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42-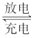 2PbSO4+2H2O 请回答下列问题(不考虑氢、氧的氧化还原):
2PbSO4+2H2O 请回答下列问题(不考虑氢、氧的氧化还原):
(1)放电时,正极的电极反应式是________________;电解液中H2SO4的浓度将变________;当外电路通过1?mol电子时,理论上负极板的质量增加________g.
(2)在完全放电耗尽PbO2和Pb时,若按下图连接,电解一段时间后,则在A电极上生成________,B电极上生成________,此时铅蓄电池的正负极的极性将________.
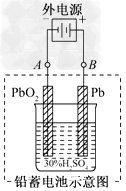
参考答案:(1)PbO2+2e-+4H++SO42-===PbSO4+2H2O;小;48
(2)Pb;PbO2;对换
本题解析:
本题难度:一般
3、选择题 某学生欲完成反应2HCl+2Ag=2AgCl+H2↑而设计了下列四个实验,你认为可行的是( )
A.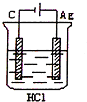
B.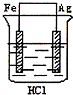
C.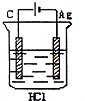
D.
参考答案:2HCl+2Ag=2AgCl↓+H2↑不能自发进行,所以必须设计成电解池,该反应中银失电子,所以银作电解池阳极,金属或导电的非金属作电解池阴极,该反应中氯化氢得电子生成氢气,则选取盐酸作电解质溶液,所以A项符合条件,
故选A
本题解析:
本题难度:简单
4、选择题 最早使用的化学电源(chemical power source))是锌锰电池,即大家所熟悉的干电池(dry cell),其结构如下图所示:尽管这种电池的历史悠久,但对它的电化学过程尚未完全了解。一般认为,放电时,电池中的反应如下:
E极:2MnO2+2H2O+2e-==2MnO(OH)+2OH-
F极:Zn+2NH4Cl==Zn(NH3)2Cl2+2H++2e-
总反应式:2MnO2+Zn+2NH4Cl === 2MnO(OH)+Zn(NH3)2Cl2
下列说法正确的是
[? ]
A.E极是电池的正极,发生的是氧化反应
B.F极是电池的负极,发生的是氧化反应
C.从结构上分析,锌锰电池应属于可充电电池
D.锌锰电池内部发生的氧化还原反应是可逆的
参考答案:B
本题解析:
本题难度:一般
5、简答题 (15分)氯化亚铜(CuCl)是一种白色固体,微溶于水,不溶于酒精。研究该物质的应用新领域、生产新方法及生产过程中的环保新措施都具有重要意义。
(1)镁—氯化亚铜海水电池,可用于鱼雷上。该电池被海水激活时,正极导电能力增强,同时产生气泡,则正极上被还原的物质有?、?(填化学式)。
(2)工业上以铜作催化剂,氯代甲烷和硅粉反应合成甲基氯硅烷的过程中产生大量废渣(主要成分为硅粉、铜、碳等)。某课外小组以该废渣为原料制CuCl,流程示意图如下:
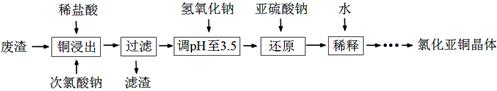
回答下列问题:
①氯代甲烷有4种,其中属于重要工业溶剂的是?(写出化学式)。
②“还原”阶段,SO32-将Cu2+还原得[CuCl2]-,完成下列离子方程式。
 Cu2++
Cu2++ Cl-+
Cl-+ SO32-+
SO32-+ ?=
?= [CuCl2]-+
[CuCl2]-+ ?+
?+ ?
?
③在稀释过程中存在下列两个平衡:
ⅰ [CuCl2]- CuCl+Cl-? K=2.32
CuCl+Cl-? K=2.32
ⅱ CuCl(s) Cu+(aq)+Cl-? Ksp=1.2×10-6
Cu+(aq)+Cl-? Ksp=1.2×10-6
当[CuCl2]-完成转化时(c([CuCl2]-)≤1.0×10-5 mol·L-1),溶液中c(Cu+)≥?。
④获得CuCl晶体需经过滤、洗涤、干燥。洗涤时,常用无水乙醇代替蒸馏水做洗涤剂的优点是?(写一点)。
(3)工业生产CuCl过程中产生浓度为2~3 g·L-1的含铜废水,对人及环境都有较大的危害,必须进行回收利用。用萃取法富集废水中的铜,过程如下:

①实验室完成步骤ⅰ时,依次在分液漏斗中加入曝气后的废水和有机萃取剂,经振荡并?后,置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先?,然后打开活塞放出下层液体,上层液体从上口倒出。
②写出步骤ⅱ的离子方程式:?。
参考答案:(1)CuCl、H2O(或H+)(各1分,共2分) (2)①CHCl3或CCl4(任写一个就得分,1分)
②2Cu2++4Cl-+1SO32-+1? H2O?=2[CuCl2]-+1? SO42-?+2? H+(3分)
③5.17×10-2mol·L-1?(2分) ④避免CuCl溶于水而损失(或其他合理答案)(2分)
(3)①放气(1分)?打开上口玻璃塞(或使塞上的凹槽对准漏斗口上的小孔)(1分)
②R2Cu+2H+=Cu2++2RH(3分)
本题解析:(1)镁是活泼的金属,因此在镁—氯化亚铜海水电池中镁是负极,失去电子,正极得到电子,发生还原反应。该电池被海水激活时,正极导电能力增强,同时产生气泡,该气体应该是氢气,这说明正极上得到电子的物质有CuCl、H2O(或H+)。
(2)①氯代甲烷有4种,其中属于重要工业溶剂的是CHCl3或CCl4。
②根据方程式可知,在反应中铜元素的化合价从+2价降低到+1价,得到1个电子。硫元素的化合价从+4价升高到+6价,失去2个电子,所以根据电子得失守恒可知氧化剂与还原剂的物质的量之比是2:1.根据原子守恒和电荷守恒可知,反应前还有水参加,反应后还有氢离子生成,因此配平后的离子方程式为2Cu2++4Cl-+SO32-+H2O =2[CuCl2]-+SO42- ?+2H+。
③根据方程式可知K=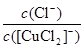 、Ksp=c(Cu+)·c(Cl-),则c(Cu+)=
、Ksp=c(Cu+)·c(Cl-),则c(Cu+)=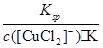 ?,因此(c([CuCl2]-)≤1.0×10-5 mol·L-1),溶液中c(Cu+)≥5.17×10-2mol·L-1。
?,因此(c([CuCl2]-)≤1.0×10-5 mol·L-1),溶液中c(Cu+)≥5.17×10-2mol·L-1。
④CuCl在有机溶剂中的溶解度小能,用无水乙醇代替蒸馏水可以避免CuCl溶于水而损失。
(3)①在振荡过程中有关随时放气。分液时应该打开上口玻璃塞(或使塞上的凹槽对准漏斗口上的小孔)。
②铜离子与氢离子交换加入水层,因此反应的离子方程式为R2Cu+2H+=Cu2++2RH。
本题难度:一般