微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 赤铜矿的成分是Cu2O,辉铜矿的成分是Cu2S,将赤铜矿与辉铜矿混合加热有以下反应:Cu2S + 2Cu2O 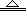 ?6Cu + SO2↑。对于该反应的下列说法正确的是
?6Cu + SO2↑。对于该反应的下列说法正确的是
A.该反应中的氧化剂只有Cu2O
B.Cu2O在反应中既是氧化剂又是还原剂
C.Cu既是氧化产物又是还原产物
D.氧化产物与还原产物的物质的量之比为1:6
参考答案:D
本题解析:略
本题难度:简单
2、选择题 将0.03 mol Cl2缓缓通入含0.02mol H2SO3和0.02 mol HBr的混合溶液中,在此过程溶液的c(H+)与Cl2用量的关系示意图是(溶液的体积视为不变)(?)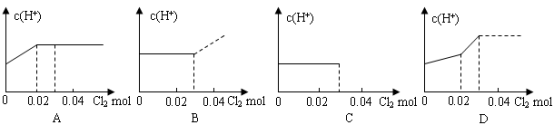
参考答案:A
本题解析:将Cl2缓缓通入含H2SO3和HBr的混合溶液中,由于亚硫酸的还原性强于溴化氫的还原性,所以,氯气优先和亚硫酸反应,所以刚开始的一段,氢离子浓度会增大,原因是:H2O+Cl2+H2SO3= H2SO4+ 2HCl ,所以氯气的用量从0-0.02mol时,氢离子浓度会增大,然后把亚硫酸反应完后接下来和溴化氫反应:2HBr+Cl2 = Br2+ 2HCl,反应前后氢离子浓度不变。故选A。
点评:解答本题需要注意的是,对于同一种氧化剂和多种还原剂反应时,优先的是跟还原性强的物质发生氧化还原反应。
本题难度:简单
3、选择题 将SO2少量通入Fe2(SO4)3溶液中发生反应:SO2+2Fe3++2H2O=SO42-+2Fe2++4H+;然后再加入K2Cr2O7溶液,发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O.下列判断正确的是( )
A.还原性Cr3+>Fe2+>SO2
B.氧化性Cr2O72->SO2>Fe3+
C.两个反应中Fe2(SO4)3均作还原剂
D.Cr2O72-能将SO2氧化成SO42-
参考答案:A、反应SO2+2Fe3++2H2O=SO42-+2Fe2++4H+中,SO2是还原剂,Fe2+是还原产物,所以还原性:Fe2+<SO2,故A错误;
B、反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O中,氧化剂是Cr2O72-,氧化产物是Fe3+,所以氧化性:Cr2O72->Fe3+,反应SO2+2Fe3++2H2O=SO42-+2Fe2++4H+中,SO2是还原剂,Fe3+是氧化剂,所以氧化性SO2<Fe3+,故B错误;
C、第一个反应中Fe2(SO4)3做氧化剂,第二个反应中Fe2(SO4)3是氧化产物,故C错误;
D、具有强氧化性的Cr2O72-能将还原性的SO2氧化成SO42-,故D正确.
故选D.
本题解析:
本题难度:一般
4、选择题 将碘水滴入Na2S溶液中,溶液浑浊;将溴水滴入KI溶液中,溶液由无色变为褐色,通过以上两个实验可得到的正确结论是( )
A.离子的氧化性由强到弱的顺序为:Br->I->S2-
B.离子的还原性由强到弱的顺序为:Br->I->S2-
C.元素的非金属性由强到弱的顺序为:Br->I->S2-
D.离子的还原性由强到弱的顺序为:Br-<I-<S2-
参考答案:因为非金属性强的能够把非金属性弱的从它的盐溶液中置换出来,由I2+Na2S=2NaI+S↓可以判断出,氧化性I2>S,
根据将溴水滴入KI溶液中,溶液由无色变为褐色,即Br2+2KI=2KBr+I2,得出氧化性顺序是Br2>I2,
所以氧化性顺序是:Br2>I2>S,单质的氧化性越强,则离子的还原性越弱,所以离子的还原性顺序是:Br-<I-<S2-.
A、单质氧化性顺序是:Br2>I2>S,离子的还原性顺序是:Br-<I-<S2-,故A错误;
B、离子的还原性顺序是:Br-<I-<S2-,故B错误;
C、还原性离子Br-、I-、S2-没有氧化性,故C错误;
D、离子的还原性由强到弱的顺序为:Br-<I-<S2-,故D正确.
故选D.
本题解析:
本题难度:一般
5、选择题 有A、B、C、D四种物质,已知它们能发生下列变化:①A2++B===B2++A、②A2++C===C2++A、③B2++C===C2++B、④C2++D===D2++C。由此可推知,各物质的氧化性、还原性强弱顺序正确的是
A.氧化性:A2+>B2+>C2+>D2+
B.氧化性:D2+>B2+>C2+>A2+
C.还原性:A>C>B>D
D.还原性:A>B>C>D
参考答案:A ?
本题解析:由氧化性还原性强弱比较规律:氧化剂的氧化性>氧化产物的氧化性;还原剂的还原性>还原产物的还原性。由反应①知氧化性:A2+>B2+,还原性:B>A,由②知氧化性:A2+>C2+,还原性:C>A;由③知氧化性:B2+>C2+,还原性:C>B,由④知氧化性C2+>D2+,还原性:D>C。综合①~④可得氧化性:A2+>B2+>C2+>D2+,还原性:D>C>B>A,则A项正确。
本题难度:一般