| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《电解池原理》高频试题强化练习(2017年最新版)(二)
参考答案:B 本题解析:电解饱和食盐水,阴极上的电极反应式为2H++2e-=H2↑,当阴极附近有0.4molOH-生成时,说明在该极上减少的氢离子为0.4mol,所以会转移电子0.4mol,阳极电极反应式为2Cl--2e- 本题难度:一般 2、选择题 以Pt为电极,电解含有金属离子M+、N3+各0.10mol的溶液,阴极析出的金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图所示.对离子氧化能力的强弱判断正确的是(选项中H+为氢离子)( ) |
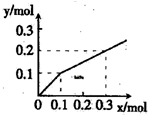
参考答案:通电后就有固体生成,当通过电子为0.1mol时,析出固体或气体的量开始增大,证明此时析出的固体是银,此后,继续有电子通过,不再有固体析出,这时会形成氢气,说明X3+不放电,银离子先于H+放电,银离子先于H+放电,故氧化能力为M+>H+>N3+.
故选C.
本题解析:
本题难度:一般
3、选择题 将1L含有2mol?CuSO4和1molNaCl的水溶液用惰性电极电解.电解一段时间后,一个电极上得到0.4mol?Cu,另一电极析出的气体( )
A.只有Cl2
B.只有O2
C.既有Cl2又有O2
D.只有H2
参考答案:溶液中含有n(Cu2+)=2mol,n(Cl-)=1mol;用惰性电极电解,电解一段时间后,一个电极上得到0.4mol Cu,是阴极反应,另一电极析出的气体为阳极反应;发生的电极反应为:根据得到铜物质的量计算电子转移,阳极电子转移守恒分析判断离子反应情况;
阴极电极反应:Cu2++2e-=Cu;
?0.4mol 0.8mol? 0.4mol
则阳极电极反应:2Cl--2e-=Cl2↑;
?0.8mol 0.8mol? 0.4mol
依据上述分析和计算,根据电子守恒得到,阳极反应生成的气体是0.4mol的氯气;
故选A.
本题解析:
本题难度:简单
4、选择题 利用下图所示联合装置制备金属钛,下列叙述正确的是
A.甲装置中通入O2的电极反应式为:O2+4 e-= 2O2-
B.若不考虑能量的损失,制备24.0g金属钛,需要消耗氢气22.4 L
C.甲装置工作过程中pH减小
D.乙装置中的石墨电极反应式为:C+2O2--4e-=CO2↑
参考答案:D
本题解析:A、根据图中得知:电解质是磷酸,氧气产生的O2-跟H+结合生成H2O,电极反应式:O2+4e-+4H+=2H2O,错误;B、题目中不知道条件是不是标准状况,不能应用22.4mol/L,错误;C、甲装置反生的总电极反应式:2H2+O2=2H2O,对磷酸稀释,pH增大,错误;D、乙装置中的石墨,连接甲装置的正极,因此石墨做阳极,根据图乙装置C+2O2--4e-=CO2↑,正确。
考点:考查原电池和电解池的原理。
本题难度:困难
5、填空题 )如图是一个用铂丝作电极,电解稀的MgSO4溶液的装置,电解液中加有中性红指示剂,此时溶液呈红色。(指示剂的pH变色范围:6.8~8.0,酸色—红色,碱色—黄色)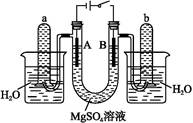
回答下列问题:
(1)下列关于电解过程中电极附近溶液颜色变化的叙述正确的是 (填编号);
①A管溶液由红变黄
②B管溶液由红变黄
③A管溶液不变色
④B管溶液不变色
(2)写出A管中发生的反应: ;
(3)写出B管中发生的反应: ;
(4)检验a管中气体的方法是 ;
(5)检验b管中气体的方法是 ;
(6)电解一段时间后,切断电源,将电解液倒入烧杯内观察到的现象是 。
参考答案:(1)①④
(2)2H++2e- H2↑、Mg2++2OH-
H2↑、Mg2++2OH- Mg(OH)2↓
Mg(OH)2↓
(3)4OH--4e- 2H2O+O2↑
2H2O+O2↑
(4)用拇指按住管口,取出试管,靠近火焰,放开拇指,有爆鸣声,管口有蓝色火焰
(5)用拇指按住管口,取出试管,放开拇指,将带有火星的木条伸入试管内,木条复燃
(6)溶液呈红色,白色沉淀溶解(或大部分溶解)
本题解析:由装置图可知A为电解池的阴极,电极反应为:4H++4e- 2H2↑;B为电解池的阳极,电极反应为:4OH--4e-
2H2↑;B为电解池的阳极,电极反应为:4OH--4e- 2H2O+O2↑。根据放电情况可知A极由于H+放电附近显碱性,指示剂应显黄色,同时还会发生反应Mg2++2OH-
2H2O+O2↑。根据放电情况可知A极由于H+放电附近显碱性,指示剂应显黄色,同时还会发生反应Mg2++2OH- Mg(OH)2↓;B极由于OH-放电附近显酸性,指示剂仍显本身的颜色红色。在检验H2时利用其可燃性,检验O2时利用其能使带火星的木条复燃的性质进行检验。由于该电解池实质是电解水,所以将电解液倒入烧杯后,整个溶液呈中性,故指示剂变红,Mg(OH)2沉淀会消失。
Mg(OH)2↓;B极由于OH-放电附近显酸性,指示剂仍显本身的颜色红色。在检验H2时利用其可燃性,检验O2时利用其能使带火星的木条复燃的性质进行检验。由于该电解池实质是电解水,所以将电解液倒入烧杯后,整个溶液呈中性,故指示剂变红,Mg(OH)2沉淀会消失。
考点:原电池、电解
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《未知》试题.. | |