微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 据最新报道,科学家发现了如下反应:O2+PtF6=O2(PtF6)。已知O2(PtF6)为离子化合物,其中Pt为+5价,对于此反应正确的是
A.在此反应中,每生成1mol O2(PtF6)则转移1mol电子
B.在此反应中,O2是氧化剂,PtF6是还原剂
C.O2(PtF6)中氧元素的化合价是+1价
D.O2(PtF6)中仅存在离子键不存在其它化学键
参考答案:A
本题解析:PtF6中Pt的化合价是+6价的,而在生成物中是+5价的,所以PtF6是氧化剂,氧气是还原剂。A正确,B不正确。O2(PtF6)中氧元素的化合价是+0.5价,C不正确。由于O2(PtF6)为离子化合物,阳离子是O2-,氧原子和氧原子之间存在非极性键,D不正确。答案选A。
本题难度:一般
2、填空题 (1)用盐酸可以除去铜器表面的铜绿,该反应的化学方程式为:
______?______________
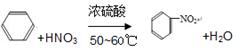
(2)写出苯发生硝化反应的化学方程式:
___________________________________________________________________
参考答案:(1)Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑
(2)
本题解析:(1)Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑
(2)
本题难度:一般
3、选择题 化学工业是国民经济的支柱产业,下列生产过程中不涉及氧化还原反应的是
A.纯碱厂用侯氏制碱法制纯碱
B.硝酸厂用氨氧化法制硝酸
C.硫酸厂用接触法生产硫酸
D.氮肥厂用氮气和氢气合成氨气
参考答案:A
本题解析:A项是利用了物质的溶解度不同;B、C、D项均涉及氧化还原反应。
本题难度:一般
4、填空题 高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
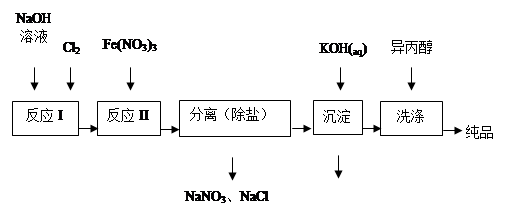 ①洗涤粗品时选用异丙醇而不用水的理由是: 。
①洗涤粗品时选用异丙醇而不用水的理由是: 。
②反应I的化学方程式为 。
③反应II的离子方程式为 。
④已知25℃时Fe(OH)3的Ksp = 4.0×10-38,反应II后的溶液中c(Fe3+)=4.0×10-5 mol/L,则需要调整pH= 时,开始生成Fe(OH)3(不考虑溶液体积的变化)。
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾。
①加入饱和KOH溶液的目的是: 。
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠 (填“大”或“小”)。
湿法
| 强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
|
干法
| Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
|
(3)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为 。
参考答案:(共15分,除(1)③3分外其它每空2分)
(1)①减少高铁酸钾的溶解损失(2分)
②2NaOH+Cl2=NaCl+NaClO+H2O(2分)
③3ClO-+10OH-+2Fe3+=2FeO42-+3Cl-+5H2O(3分)
④3(2分)
(2)①增大K+浓度,促进K2FeO4晶体析出(2分) ②小(2分)
(3)3:1(2分)
本题解析:
(1)①钾盐易溶于水,用有机溶剂可以避免钾盐的损失
②氯气与氢氧化钠反应生成氯化钠、次氯酸钠、和水。
③上一步反应生成了次氯酸根,作为唯一的氧化剂氧化三价铁离子生成氯离子和高铁酸盐。
④Ksp〔Fe(OH)3〕=c3(OH-)·c(Fe3+)算出,c(OH-)=10-11,根据pH的算法,pH=3.
(2)①Ksp〔K2FeO4〕=c2(K+)·c(FeO42-),故增加钾离子浓度可以析出K2FeO4晶体。
②否则就用同样类似的方法制备Na2FeO4了。
(3)N得到2个电子,Fe 得到3个电子,所以N*3,Fe *2,又因为是Fe2O3(重点是Fe2),故比例为3:1.
考点:考查氧化还原反应,以及非金属单质及其化合物,化学反应原理等。
本题难度:困难
5、选择题 含有a mol FeBr2的溶液中,通入 x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-