微信搜索关注"91考试网"公众号,领30元,获取公务员、事业编、教师等考试资料40G!
1、选择题 设NA为阿伏加德罗常数的值,下列叙述正确的是
①常温常压下,18g14CH4所含中子数目为8 NA
②1L0.1mol·L-1的氨水中有NA个NH4+
③1mol Na2O2中含有NA个阴离子
④1L1mol·L-1NaClO 溶液中含有ClO-的数目为NA
⑤78g 苯含有C=C双键的数目为3NA
⑥0.1molN2和0.3molH2在某密闭容器中充分反应,转移电子的数目为0.6NA
⑦60gSiO2晶体中含有硅氧键的数目为4NA
A.①③⑦
B.②③⑥
C.②④⑥
D.①④⑤⑦
参考答案:A
本题解析:①常温常压下,18g14CH4的物质的量是1mol,1个甲烷分子中有8个中子,所以18g14CH4所含中子数目为8 NA,正确;②一水合氨是弱碱,不完全电离,所以溶液中的NH4+数目小于NA个,错误;③1mol Na2O2中含有NA个阴离子,正确;④ClO-水解使ClO-数目小于NA个,错误;⑤苯中不存在碳碳双键,错误;⑥合成氨的反应是可逆反应,不会进行到底,错误;⑦60gSiO2的物质的量是1mol,每个硅原子周围与4个O原子相连,所以硅氧键的数目为4NA,正确,答案选A。
本题难度:一般
2、计算题 (7分)实验室常用浓盐酸和二氧化锰反应来制取少量氯气,反应的化学方程式为:MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O。取8.7g的MnO2与50mL足量的浓盐酸发生反应制取氯气。求:
MnCl2 + Cl2↑ + 2H2O。取8.7g的MnO2与50mL足量的浓盐酸发生反应制取氯气。求:
①(忽略Cl2的溶解)产生的氯气在标准状况下的体积为_________,参加反应的HCl有______mol。(4分)
②若向反应后的剩余溶液中,加入足量AgNO3溶液,生成沉淀57.4g,求原浓盐酸的物质的量浓度 。(3分)
参考答案:①2.24L 0.4 ② 12mol/L
本题解析:
MnO2 + 4HCl(浓) MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
87g 4mol 22.4L
8.7g n(HCl) V(HCl)
V(HCl) =2.24L n(HCl)=0.4mol 溶液中剩余的Cl-的物质的量为0.2mol,
而57.4gAgCl的物质的量为0.4mol,确定0.2molHCl过量,所以HCl的总量为0.6mol,浓度为12mol/L.
考点:物质的量及物质的量浓度的计算。
本题难度:一般
3、计算题 (7分)实验室用20 g软锰矿(主要成分MnO2)与200 mL 12 mol/L的浓盐酸(足量)反应,制得标准状况下4.48L Cl2。过滤反应后的混合物得滤液,向滤液中加入足量的硝酸银溶液,产生白色沉淀。若浓盐酸的挥发忽略不计,试计算:
(1)软锰矿中MnO2的质量分数是多少?
(2)反应中被氧化的HCl物质的量为多少?
(3)滤液中加入足量硝酸银后产生的白色沉淀的质量是多少?
参考答案:⑴87%? ⑵0.4mol? ⑶287g
本题解析: MnO2+4HCl(浓)  MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
1? 4? 1? 1?
xmol? ymol? zmol?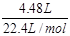
计算可知:x=0.2mol? y=0.8mol? z=0.2mol
MnO2的质量分数=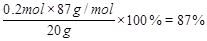
被氧化的HCl是参加反应的HCl的一半,所以被氧化的HCl为0.4mol
溶液中有n(Cl-)=0.4mol,所以产生氯化银的质量为0.4mol×143.5g/mol=287g
答:略
点评:本题是典型的通过物质的量计算的习题,对提高学生的计算水平有很大帮助。尤其近几年高考中化学已经出现书写计算过程的考题了,对于书写计算过程更应该注重步骤的完整。
本题难度:一般
4、计算题 (4分)(1)密度为1.17g/cm3,浓度为36.5%的浓盐 酸中HCl的物质的量的浓度为 。
酸中HCl的物质的量的浓度为 。
(2)Na2O和Na2O2的混合物14g和足量的水反应,得到300mL溶液,其中含溶质16g。原混合物中Na2O和Na2O2的质量分别多少 。
参考答案:(1)11.7mol/L (2分,单位漏写扣1分)(2) Na2O 6.2g,Na2O2 7.8g。(各1分)
本题解析:略
本题难度:一般
5、选择题 某气体物质,经测定其蒸气密度折合成标准状况约为1.5 g/L。该化合物可能是下列的
A.HCl
B.H2S
C.CH4
D.C2H6